
【题目】现有常温条件下浓度均为0.1 molL-1的甲、乙、丙、丁四种溶液,甲为NaOH溶液,乙为HCl溶液,丙为CH3COOH溶液,丁为氨水,已知Ka(CH3COOH)=Kb(NH3H2O)试回答下列问题:
(1)甲、丁种溶液中由水电离出的c(OH)的大小关系为甲___丁(填“大于”“小于”或“等于”)。
(2)将一定体积的甲与乙混合,所得溶液pH=12,则二者的体积比为v甲∶v乙=___。
(3)某同学用甲滴定丙溶液、乙滴定丁溶液,得到如图所示两条滴定曲线,请完成有关问题:
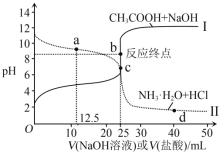
①乙溶液滴定丁溶液最适合的指示剂是___;甲溶液滴定丙溶液,选用酚酞为指示剂,则达到滴定终点的标志是___。
②计算滴定至b点时,c(CH3COOH)+c(CH3COO-)=___molL-1
③向氨水中滴加盐酸至a点,溶液中离子浓度从大到小的顺序为___,若加盐酸vmL时,溶液恰好呈中性,用含v的代数式表示出Kb=___(不考虑溶液混合体积变化)。
【答案】小于 9:11 甲基橙 溶液由无色变为浅红色,且半分钟不褪色 0.05molL-1 c(NH4+)>c(Cl-)>c(OH-)>c(H+) ![]() ×10-4mol/L
×10-4mol/L
【解析】
(1)碱抑制水的电离,c(OH-) 越大抑制程度越大,0.1 molL-1的NaOH溶液和氨水中,前者c(OH-)大,水的电离程度小,故甲、丁两种溶液中由水电离出的c(OH)的大小关系为甲小于丁;
(2)将一定体积的甲与乙混合,所得溶液pH=12,则![]() =0.01,二者的体积比为v甲∶v乙=9:11;
=0.01,二者的体积比为v甲∶v乙=9:11;
(3)①HCl溶液滴定氨水,恰好完全反应生成氯化铵,氯化铵水解呈酸性,甲基橙变色范围是3.1-4.4可以指示反应终点,则滴定终点最适合的指示剂是甲基橙;甲溶液滴定丙溶液,选用酚酞为指示剂,则达到滴定终点的标志是溶液由无色变为浅红色,且半分钟不褪色;
②因CH3COOH溶液和NaOH溶液的浓度均为0.1 molL-1,滴定至b点时,两溶液均为25mL,溶液体积增加一倍,根据物料守恒:c(CH3COOH)+c(CH3COO-)=0.05molL-1;
③向氨水中滴加盐酸至a点,所得溶液为氯化铵和NH3H2O按1:1形成的溶液,溶液呈碱性,则NH3H2O电离大于氯化铵的水解,溶液中离子浓度从大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+),若加盐酸vmL时,溶液恰好呈中性,c(OH-)=c(H+)=10-7mol/L,c(NH4+)=c(Cl-),n(Cl-)=0.1 molL-1×v×10-3L= v×10-4mol,设溶液的体积为V总,则c(NH4+)=c(Cl-)= ![]() ×10-4mol/L,c(NH3H2O)=
×10-4mol/L,c(NH3H2O)= ![]() ×10-4mol/L,用含v的代数式表示出Kb=
×10-4mol/L,用含v的代数式表示出Kb= =
= ![]() ×10-4mol/L。
×10-4mol/L。


科目:高中化学 来源: 题型:
【题目】(1)基态溴原子的价层电子轨道排布式为________,第四周期中,与溴原子未成对电子数相同的金属元素有 ______种。
(2)铍与铝的元素性质相似。下列有关铍和铝的叙述正确的有_________(填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)OF2分子中,O的杂化类型为______,与下列微粒的中心原子杂化方式相同且空间构型也与OF2相同的是_______(填字母), OF2分子VSEPR模型的名称为__________
A.PCl3 B.SO3 C. NH2- D.NO3-
(4)P元素有白磷、红磷、黑磷三种常见的单质。
①白磷(P4)易溶于CS2,难溶于水,原因是_____________________________________________。
②黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是_______。
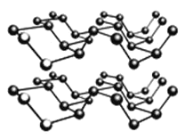
A.黑磷晶体中磷原子杂化方式为sp2杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(5)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。其晶胞与金刚石相似,其中B原子处于晶胞体内,P原子处于晶胞表面。
①磷化硼晶体属于_____晶体(填晶体类型),_____ (填“是”或“否”)含有配位键。
③已知BP的晶胞中最近的B与P原子核间距为a nm,NA为阿伏加德罗常数的数值,则磷化硼晶体的密度表达式为________________g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-542.7kJ/mol
B. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1059.3kJ/mol
C. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7kJ/mol
D. N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g) ΔH=-1076.7kJ/mol
N2(g)+2H2O(g) ΔH=-1076.7kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.b点所示溶液中[A-]>[HA]
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,[Na+]=[A-]+[HA]
D.a点所示溶液中[Na+]>[A-]>[H+]>[HA]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是( )
A. PH3和AsH3的熔点
B. Br2在水中的溶解度和Br2在CCl4溶液中的溶解度
C. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
D. HClO和HClO4的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NOx的烟气,反应温度为323K,NaClO2碱性溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/mol·L1 | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2碱性溶液脱硝(NO)过程中主要反应的离子方程式:____。增加压强,NO的转化率___(填“提高”“不变”或“降低”)
②由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
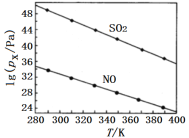
由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均___(填“增大”“不变”或“减小”)。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将28.8g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为___L,NO2的体积为___L;
(2)待产生的气体全部释放,向溶液中加入200mL5mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图:
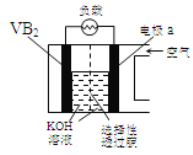
该电池工作时反应为:4VB2+ 11O2 = 4B2O3+ 2V2O5。下列说法正确的是
A.VB2极发生的电极反应为:2VB2+ 22OH-22e=V2O5+ 2B2O3+ 11H2O
B.电极a为电池负极
C.电流由VB2极经负载流向电极a
D.图中选择性透过膜允许阳离子选择性透过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将SO2通入下列不同溶液中,实验现象与所得结论不正确的是
溶液 | 现象 | 结论 |
| |
A | 品红溶液 | 红色溶液褪色 | SO2有漂白性 | |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 | |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 | |
D | 滴有酚酞的NaOH溶液 | 红色溶液褪色 | SO2的水溶液呈酸性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com