
【题目】己知:25℃时,CaCO3的Ksp=2.8×10-9,现将Na2CO3浓度为2×10-4mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应大于
A. 2.8×10-2mol·L-1 B. 5.6×10-5mol·L-1
C. 2.8×l0-5 mol·L-1 D. 1.4×l0-5mol·L-1
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列有关细胞中的物质说法正确的是
A. 水是生物体内物质运输的唯一介质 B. 铁离子是血红蛋白的必要成分
C. 构成细胞的物质主要是有机化合物 D. 无机盐全部以离子形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酶的叙述错误的是( )
A.蛋白酶能催化所有水解反应B.绝大多数酶是蛋白质
C.酶是生物体产生的催化剂D.蛋白酶受到高温或重金属盐作用时会变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在无色溶液中能大量共存的是
A.H+、Cl-、SO42-、K+B.K+、H+、Na+、HCO3-
C.Cu2+、K+、SO42-、Cl-D.Ag+、NO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2=Fe+2Li2S.下列说法不正确的是( ) 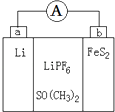
A.该装置将化学能转化为电能
B.电子移动方向是由a极流向b极
C.可以用水代替SO(CH3)2做溶剂
D.b极反应式是FeS2+4Li++4e﹣=Fe+2Li2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) △H =-129.0kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为______________。
(2)将1.0molCH4和2.0molH2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如下图。
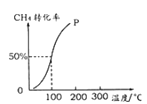
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为_______。
(3)在压强为0.1MPa、温度为300℃条件下,将amolCO与3amol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的![]() ,其他条件不变,对平衡体系产生的影响是__________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是__________(填字母序号)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡![]() 减小 E.平衡常数K增大
减小 E.平衡常数K增大
(4)1mol甲醇完全燃烧产生气体通入1L1.5mol/L的NaOH溶液反应,反应后的溶液中各离子浓度大小关系为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com