
����Ŀ��CuSO4��Cu(NO3)2����Ȼ������Ҫ��ͭ�Ρ��ش��������⣺
��1��CuSO4��Cu(NO3)2�������ӻ�̬��������Ų�ʽΪ_________��S��O��N����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ_________��
��2����Cu(NO3)2��Һ��ͨ������NH3�����������[Cu(NH3)4] (NO3)2������NO3-����ԭ�ӵ��ӻ��������Ϊ_________��[Cu(NH3)4]NO3)2�д��ڵĻ�ѧ�����ͳ��˼��Թ��ۼ��⣬����_________��
��3��������ͭ��Һ�м������KCN������������[Cu(CN)4]2-,CN-���ṩ�µ��ӶԵ�ԭ����_________�� lmol CN-�к��еĦм�����ĿΪ_________����CN-��Ϊ�ȵ������������_________ ��д��һ�ּ��ɣ�
��4��CuSO4���۵�Ϊ560��C��,Cu(NO3)2���ܵ�Ϊ115��C,CuSO4�ܵ���ߵ�ԭ����_________��
��5������CuSO4��NaOH�Ʊ���Cu(OH)2����ȩ��ʱ�����ɺ�ɫ��Cu2O ,�侧���ṹ��ͼ��ʾ��
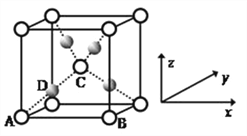
�þ���ԭ���������AΪ��0��0��0)��BΪ��1��0��0) ��CΪ��![]() ��
��![]() ��
��![]() ������Dԭ�ӵ��������Ϊ_________��������_________ԭ��(��Ԫ�ط���)��
������Dԭ�ӵ��������Ϊ_________��������_________ԭ��(��Ԫ�ط���)��
����֪����ͭ�Ķѻ���ʽ�������������ܶѻ���������ͭԭ�ӵ���λ����_________���þ�����Cuԭ�ӵĿռ���������_________��
���𰸡� [Ar]3d9 �� lS22s22p63s23p63d9 N>O>S sp2 ��λ�������Ӽ� N 2NA��2��6.02��1023 C22- CuSO4��Cu(NO3)2��Ϊ���Ӿ��壬SO42-������ɱ�NO3-��CuSO4�����ܽϴ��۵�ϸߡ� ��![]() ��
��![]() ��
��![]() �� Cu 12 74%
�� Cu 12 74%
����������1��CuSO4��Cu(NO3)2�������Ӿ���ͭ���ӣ����̬��������Ų�ʽΪ [Ar]3d9 �� lS22s22p63s23p63d9���ǽ�����Խǿ����һ������Խ����Ԫ�ص�2p������Ӵ��ڰ����״̬���ȶ���ǿ����S��O��N����Ԫ�صĵ�һ�������ɴ�С��˳��ΪN>O>S�� ��2��NO3-��Nԭ�ӵļ۲���Ӷ�����3���Ҳ����ڹ¶Ե��ӣ���ƽ�������νṹ���������ԭ�ӵ��ӻ��������Ϊsp2�ӻ���[Cu(NH3)4]NO3)2�д��ڵĻ�ѧ�����ͳ��˼��Թ��ۼ��⣬�������Ӽ���������3�������[Cu(CN)4]2-��ͭ�����ṩ�չ����NԪ���ṩ�¶Ե��ӣ��γ���λ����CN-�к�����������lmol CN-�к��еĦм�����ĿΪ2NA��2��6.02��1023��ԭ�����ͼ۵������ֱ���ȵĻ�Ϊ�ȵ����壬��CN-��Ϊ�ȵ������������C22-����4������CuSO4��Cu(NO3)2��Ϊ���Ӿ��壬SO42-������ɱ�NO3-��CuSO4�����ܽϴ���������ͭ�۵�ϸߡ���5���ٸ��ݾ����ṹ������A��B��Cԭ�ӵ�ԭ�����������֪Dԭ�ӵ��������Ϊ��![]() ��
��![]() ��
��![]() ����D������ԭ�Ӿ�λ���ڲ�������4�����������ʾ��ԭ�Ӹ�����1��8��1/8��2�����D����Cuԭ�ӡ�����֪����ͭ�Ķѻ���ʽ�������������ܶѻ���������ͭԭ�ӵ���λ����12��������ͭԭ�Ӹ�����8��1/8+6��1/2=4����ͭԭ�ӵİ뾶��r������Խ�����4r��������ı߳���
����D������ԭ�Ӿ�λ���ڲ�������4�����������ʾ��ԭ�Ӹ�����1��8��1/8��2�����D����Cuԭ�ӡ�����֪����ͭ�Ķѻ���ʽ�������������ܶѻ���������ͭԭ�ӵ���λ����12��������ͭԭ�Ӹ�����8��1/8+6��1/2=4����ͭԭ�ӵİ뾶��r������Խ�����4r��������ı߳���![]() ���������������ǣ�
���������������ǣ�![]() ��3����˸þ�����Cuԭ�ӵĿռ���������
��3����˸þ�����Cuԭ�ӵĿռ���������![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I����֪��P4�����ף�+3O2��g��= P4O6��g���ķ�Ӧ�ȡ�H=��1638 kJ��mol1 ������P4O6�ķ��ӽṹ��ͼ��ʾ����ѧ���ļ��ܣ�kJ��mol1����P��P��198 P��O��360����Ͽ�1molO2����Ҫ������Ϊ kJ

II����֪����CO(g)+1/2O2(g)=CO2(g) ��H=��141kJ��mol��1
��2H2(g)+O2(g)=2H2O(g) ��H=��484kJ��mol��1
��CH3OH��g��+3/2O2(g)=CO2(g)+2H2O(g) ��H=��883kJ��mol��1
��1������CO��H2�����Ƶ�1mol��̬�״����Ȼ�ѧ����ʽΪ ��
��2�����ں���2L�ܱ������У���1molCO��3mol H2��ַ�Ӧ������������Ϊ129KJʱ����ʱH2��ת����Ϊ ��ƽ�ⳣ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ�е����ʵ���Ũ��������
A��0.5L 0.1mol/L��NaCl��Һ B��100mL 0.2mol/L��MgCl2��Һ
C��1L 0.2mol/L��AlCl3��Һ D��1L 0.3mol/L������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά�����Dz������������������³´�л���������������ѧ��ÿ����Ҫ����һ������ά����C������������ά����C������ḻ����
A. �� B. Ϻ C. ţ�� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��Դ��ָʹ�ù����в��ŷŻ��ŷż�����Ⱦ�����Դ������������ɫ��Դ����
��̫���� ������ ��ʯ�� ��ú ����ϫ�� ��ľ�� ��������
A���٢ڢۢ� B���ڢܢݢ� C���ۢܢݢ� D���٢ڢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ������Ȼ�������о�����ȡ�����½�չ��������ͼװ�ÿɷ�����Ӧ��H2S+O2=H2O2+S����֪�׳��з����ķ�Ӧ��


����˵����ȷ���ǣ� ��
A. �׳���̼���Ϸ����ĵ缫��ӦΪAQ+2H+-2e-=H2AQ
B. �ҳ���Һ�з����ķ�ӦΪH2S+I3-=3I-+S+2H+
C. ��װ���е���ת��Ϊ����
D. H+�Ӽ׳������ҳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�������Ⱦ��������ǻ�����һ����Ҫ����������Ӧ�úʹ������Ļ��������������������Ҫ���塣
��1����֪��N2��g��+O2��g��=2NO��g�� ��H=+180.5kJmol��1
2C��s��+O2��g��=2CO��g�� ��H=��221.0kJmol��1
C��s��+O2��g��=CO2��g�� ��H=��393. 5kJmol��1
������β�������ķ�Ӧ֮һ��2NO(g)+2CO(g)=N2(g)+2CO2(g)��H=_____ kJmol��1������
�÷�Ӧ�Է����е�������_______��ѡ������������������������

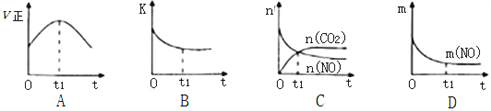
��2����0.20mol NO��0.10molCO����һ���ݻ��㶨Ϊ1L���ܱ������з�����Ӧ��
2NO��g��+2CO��g��N2��g��+2CO2��g������Ӧ������ �������ʵ�Ũ�ȱ仯��ͼ��ʾ��
��Ӧ�ӿ�ʼ��9minʱ����CO2��ʾ�÷�Ӧ��������____________________������2λ��Ч���֣�
�ڵ�12minʱ�ı��������______________���������»���������
�۵�18minʱ�����µ�ƽ�⣬���¶��µ�ƽ�ⳣ��Ϊ______________���м���ʽ������24minʱ���������¶Ȳ��䣬���������г���CO��N2��0.060mol��ƽ�⽫_____�ƶ��������������������
��3�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ��t1ʱ�̴ﵽƽ��״̬����________________������ţ���
����ͼ��v����K��n��m�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ�����������
��4����Ϊȼ�Ͽ���������찱ȼ�ϵ�أ���������Ⱦ�����缫���Ͼ�Ϊ���Ե缫��KOH��Һ���������Һ����õ�ظ����缫��ӦʽΪ______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ú�͵��ܶ���0.8gcm��3 �� �Ը��ݽ����Ƶı��淽���ͽ�������ˮ��Ӧ�������ƶϽ����Ƶ��ܶȣ� ��
A.��0.8 gcm��3
B.����1.0 gcm��3
C.����0.8��1.0 gcm��3
D.���Ʋ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��O2��F2���ܷ�����Ӧ����ͼΪH2��F2������Ӧ����HF�����е������仯ʾ��ͼ����ش�
�������⣺
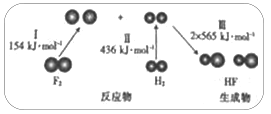
H2(g)��F2(g)��Ӧ����HF(g)�����е�������仯
(1)���ת��I��II_________(����ա��ų���,��ͬ)����,���ת����_________������
(2)H2��F2��Ӧ�������仯ͼ����___________(�A����B��)��ʾ��
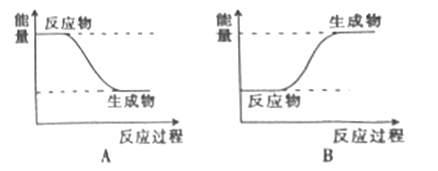
(3)H2��O2��ȼ�յĹ�����Ҫ��__________��ת��Ϊ_______�ܵĹ��̡�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com