
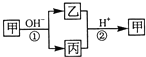
 甲是一种常见的单质,乙、丙为中学常见的化合物,甲、乙、丙均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
甲是一种常见的单质,乙、丙为中学常见的化合物,甲、乙、丙均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是( )| A、X元素可能为Al |
| B、X 元素不一定为非金属元素 |
| C、反应①和②互为可逆反应 |
| D、反应①和②一定为氧化还原反应 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A、加热平衡向右移动 |
| B、25℃时反应2C?2A(s)+B(g)的平衡常数为0.5 |
| C、在80℃时,测得某时刻,B、C浓度均为0.5mol/L,则此时v(正)>v(逆) |
| D、80℃达到平衡时,再投入一定量的A,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应物中发生氧化反应的物质PbO2 |
| B、被还原的元素是Mn(NO3)2中Mn |
| C、反应中1mol氧化剂得到5mol电子 |
| D、请将反应物配平后的PbO2与Mn(NO3)2系数之比5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
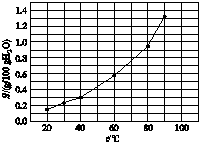
| A、60℃时溴酸银的Ksp约等于6×10-4 |
| B、温度升高时溴酸银溶解速度加快 |
| C、溴酸银的溶解时放热过程 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
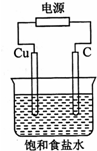
| A、石墨电极与直流电源负极相连 |
| B、用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色 |
| C、氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移 |
| D、铜电极的反应式为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、①④ | C、②③ | D、①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气通人含等物质的量的FeBr2溶液中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
| B、澄清石灰水与少量的碳酸氢钠溶液反应:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
| C、铜与浓硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O |
| D、硫酸氢钠溶液滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、按系统命名法, 的名称为2,4,5-三甲基己烷 的名称为2,4,5-三甲基己烷 |
B、分子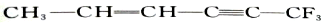 中,位于同一平面上碳原子最多有6个 中,位于同一平面上碳原子最多有6个 |
C、化合物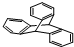 是苯的同系物 是苯的同系物 |
| D、3-甲基-3-乙基戊烷的一氯取代产物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | |||||||||||||||||
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
| 2 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com