
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
分析 ①500s内,△c(N2O5)=(5.00-3.52)mol•L-1=1.48mol•L-1,则△c(NO2)=$\frac{4}{2}×$△c(N2O5)=2×1.48mol•L-1=2.96mol•L-1,带入v=$\frac{△c}{△t}$计算;
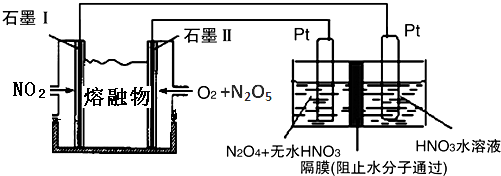
②由4NO2(g)+O2(g)=2N2O5(g)可知,NO2被氧化,因此石墨Ⅰ作为负极,电极方程式为NO2+NO3--e-═N2O5;
先根据化合价判断生成N2O5的电极,再根据离子的放电顺序写出电极反应式.
解答 解:①500s内,△c(N2O5)=(5.00-3.52)mol•L-1=1.48mol•L-1,则△c(NO2)=$\frac{4}{2}×$△c(N2O5)=2×1.48mol•L-1=2.96mol•L-1,v(NO2)=$\frac{2.96mol•L{\;}^{-1}}{500s}$=5.92×10-3mol/(L•s),
故答案为:5.92×10-3mol/(L•s);
②由4NO2(g)+O2(g)=2N2O5(g)可知,NO2被氧化,因此石墨Ⅰ作为负极,电极方程式为NO2+NO3--e-═N2O5,石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,
左侧Pt为阳极,N2O4→N2O5,氮元素化合价升高,发生氧化反应,阳极电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+,阴极发生2H++2e-=H2↑的反应,因此应该在左侧生成N2O5,即在阳极区域生成,
故答案为:NO2+NO3--e-═N2O5;N2O4+2HNO3-2e-=2N2O5+2H+.
点评 本题考查了化学反应速率的计算及其电化学原理的应用,难度较大,根据离子的放电顺序写出相应的电极反应式是关键.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 48Ti和50Ti互为同位素 | B. | 48Ti和50Ti属于两种元素 | ||
| C. | 48Ti和50Ti是同一种核素 | D. | 48Ti和50Ti互称同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
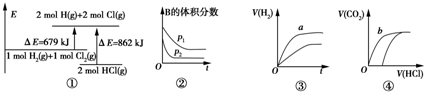
| A. | ①表示化学反应H2(g)+Cl2(g)═2HCl(g)的能量变化,则该反应的反应热△H=+183 kJ/mol | |
| B. | ②表示其他条件不变时,反应4A(g)+3B(g)═2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体 | |
| C. | ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | |
| D. | ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,80g NH4NO3中含有氮原子数是NA | |
| B. | 18gNH4+中含有的电子数为11NA | |
| C. | 5.6g铁与稀硝酸反应转移的电子数目一定为0.3NA | |
| D. | 6.4g铜与一定浓度的足量硝酸溶液反应,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,反应类型:加聚反应
,反应类型:加聚反应 ,反应类型:取代反应
,反应类型:取代反应 ,反应类型:取代反应
,反应类型:取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢管与铅连接,钢管可被保护 | |
| B. | 铁遇冷浓硫酸表面钝化,可保护内部不被腐蚀 | |
| C. | 纯铁比生铁更容易被腐蚀 | |
| D. | 钢铁发生析氢腐蚀时,负极反应是Fe-3e-═Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com