
锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是( )
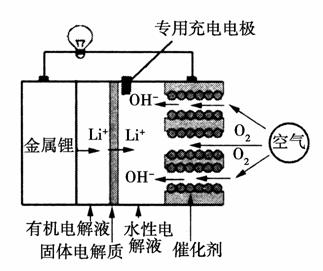
A.该电池放电时,正极的反应式为O2+4e-+4H+===2H2O
B.该电池充电时,阴极发生了氧化反应:Li++e-===Li
C.电池中的有机电解液可以用稀盐酸代替
D.正极区产生的LiOH可回收利用
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列实验装置能达到实验目的有(夹持仪器未画出) ( )
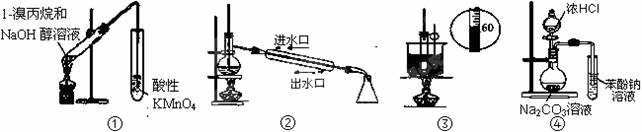
A.①装置用于检验1-溴丙烷消去产物 B.②装置用于石油的分馏
C.③装置用于实验室制硝基苯 D.④装置可证明酸性:盐酸>碳酸>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.乙烯和苯都能使溴水层褪色,褪色的原因相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.乙醇、乙酸、乙酸乙酯都能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有机玻璃(PMMA)成分为聚甲基丙烯酸甲酯,因其透光性好、性能优良、价格低廉,广泛应用于商业,轻工、建筑、化工等方面,甚至人工角膜也是有机玻璃。其单体的结构和工业合成路线如图所示。
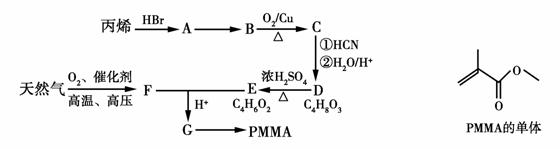
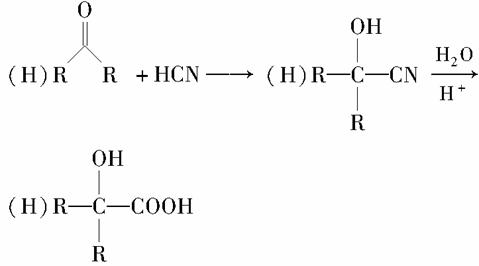
请回答下列问题:
(1)有机玻璃单体的分子式为________________。
(2)请指出反应类型:D→E属于________________反应,E+F→G属于________________反应。
(3)请指出A→B的反应条件:________________________。
(4)请写出B→C的化学方程式:______________________。
(5)写出同时符合下列条件的G的同分异构体的结构简式,请写出3种:__________________________________________________。
①能使溴水褪色;②能在碱性条件下水解;③能发生银镜反应;④具有支链。
(6)以苯乙酮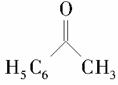 为主要原料合成
为主要原料合成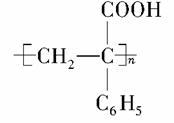 ,请设计合成路线(无机试剂任选),格式参照如下过程:CH3CHO
,请设计合成路线(无机试剂任选),格式参照如下过程:CH3CHO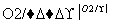 CH3COOH
CH3COOH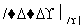 CH3COOCH2CH3。
CH3COOCH2CH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
电化学在日常生活中用途广泛,图①是镁—次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O===Cl-+Mg(OH)2,图②是Cr2O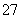 工业废水的处理。下列说法正确的是( )
工业废水的处理。下列说法正确的是( )
A.图②中Cr2O 向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3被除去
向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3被除去
B.图②的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生
C.图①中发生的还原反应是:Mg2++ClO-+H2O+2e-===Cl-+Mg(OH)2↓
D.若图①中3.6 g镁溶解产生的电量用以图②废水处理,则理论可产生10.7 g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如下图,则下列说法正确的是( )
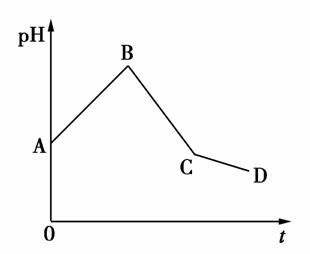
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.BC段表示在阴极上是H+放电产生了H2
C.整个过程中阳极先产生Cl2,后产生O2
D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
查看答案和解析>>
科目:高中化学 来源: 题型:
500 ℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示(10 min时达到第一次平衡),下列说法正确的是( ) 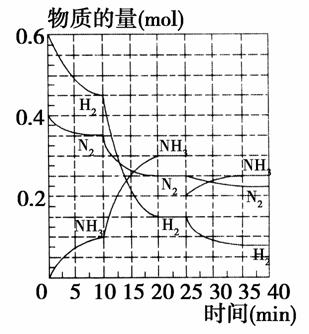
A.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L·min)
B.从曲线可以看出,反应进行到10 min至20 min时可能是使用了催化剂
C.从曲线可以看出,反应进行至25 min时,增加了0.1 mol的氨气
D.在25 min时平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s)+H2O(g)CO(g)+H2(g),该反应的化学平衡常数表达式为K=________。
若反应的逆反应速率与时间的关系如图所示:
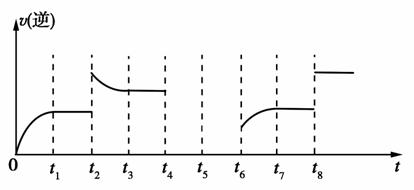
①可见反应在t1、t3、t7,时都达到了平衡,而t2、t8时都改变了一种条件,试判断t2时改变的是什么条件:t2时________________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
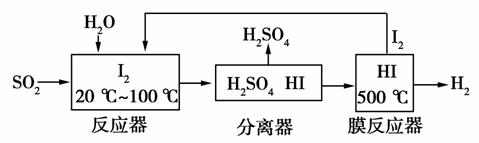
①用离子方程式表示反应器中发生的反应:________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO2 3CO2+N2O。下列关于N2O的说法正确的是 ( )
3CO2+N2O。下列关于N2O的说法正确的是 ( )
A .上述反应中每生成1 mol N2O,消耗1.5 mol CO
.上述反应中每生成1 mol N2O,消耗1.5 mol CO
B.等物质的量的N2O和CO2含有相等的电子数
C.N2O只具有氧化性,无还原性
D.N2O会迅速与人体血红蛋白结合,使人中毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com