
| |
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓硫酸 NaOH溶液 CuO Cu | ||
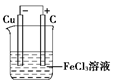 2Fe3++2e-===2Fe2+ Cu-2e-===Cu2+
2Fe3++2e-===2Fe2+ Cu-2e-===Cu2+

科目:高中化学 来源:不详 题型:单选题
| A.Fe2O3 | B.FeCl3 | C.Fe3O4 | D.FeO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
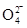 )。
)。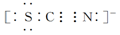
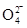 ,请写出该离子反应方程式________________________。
,请写出该离子反应方程式________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 陈述I | 陈述II | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对;II对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | I对;II对;无 |
| C | 铁属于过渡金属元素 | 铁和铁的某些化合物可以用作催化剂 | I错;II对;无 |
| D | 铁在空气中表面生成致密氧化膜 | 可用铁罐储存运输浓硫酸、浓硝酸 | I对;II对;有 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
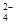 的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )| A.当消耗13克Zn时, 得到的还原产物为0.25mol |
| B.当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+ |
| C.反应中最多有两种单质生成 |
| D.反应结束时,可得到0.25molZnSO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3 : 2 | B.3 : 5 | C.4 : 3 | D.3 : 4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
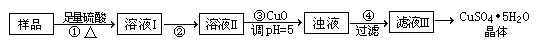
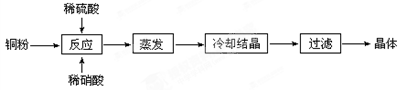
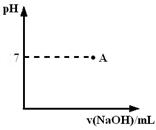
| A.醋酸 | B.草酸 | C.苯甲酸 | D.苯酚 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
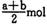 B (a — b) mol
B (a — b) mol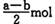 D. (a+b) mol
D. (a+b) mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com