
| A. | Na2CO3═2Na++CO32- | B. | H2O═2H++O2- | ||
| C. | HNO3═H++NO3- | D. | K2SO4═2K++SO42- |
分析 写物质的电离方程式,首先判断电解质的类型及电离出的阴阳离子,然后根据电解质的类型判断写可逆号还是等号,如果是多元弱酸,要分步电离,如果是多元弱碱,只需一步书写,最后要注意原子守恒、电荷守恒.
A.碳酸钠完全电离出钠离子和碳酸根离子;
B.水部分电离出氢离子和氢氧根离子;
C.硝酸为一元强酸完全电离出氢离子和硝酸根离子;
D.硫酸钾为强电解质完全电离出钾离子和硫酸根离子.
解答 解:A.碳酸钠属于盐,能完全电离出钠离子和碳酸根离子,电离方程式为:Na2CO3═2Na++CO32-,故A正确;
B.水属于弱电解质,部分电离出氢离子和氢氧根离子,电离方程式为:H2O?H++OH-,故B错误;
C.硝酸是强电解质,能完全电离,电离方程式为:HNO3=H++NO3-,故C正确;
D.硫酸钾为强电解质,完全电离出钾离子和硫酸根离子,电离方程式为:K2SO4═2K++SO42-,故D正确;
故选B.
点评 本题考查了电离方程式的书写,掌握电离方程式的书写方法并能灵活运用是正确解答此类题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| B. | S2?、Cl?、K+、Ca2+半径逐渐增大 | |
| C. | 核外电子排布相同的微粒化学性质也相同 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
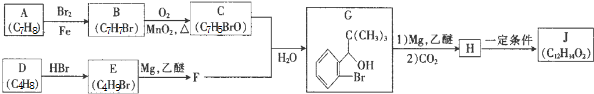
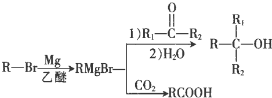
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr.,其反应类型为取代反应;
+HBr.,其反应类型为取代反应;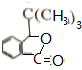 ,由D生成E的化学反应方程式为CH2=C(CH3)2+HBr→(CH3)3CBr;
,由D生成E的化学反应方程式为CH2=C(CH3)2+HBr→(CH3)3CBr;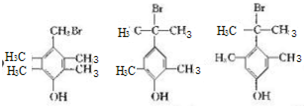 (其中一种)(写出一种即可).
(其中一种)(写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
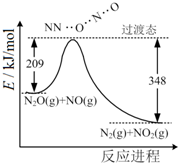
| A. | 反应生成1mol N2时转移4mole- | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)═N2(g)+NO2(g)△H=-139 kJ/mol | |
| D. | 断键吸收能量之和小于成键释放能量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 物质名称 | 氯气 | 小苏打 | 二氧化硅 | 氧化铁 |
| 用途 | 制漂白粉 | 治疗胃酸过多 | 制半导体材料 | 用作红色涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性).
H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com