
【题目】下列物质反应后一定有+3价铁生成的是( )
①少量 Fe在Cl2燃烧;② Fe与过量稀H2SO4反应;③ FeCl2溶液中加入氢氧化钠溶液;④ FeO和Fe2O3的混合物溶于盐酸中。
A. ① ② ④ B. ① ③ ④ C. ① ② ③ D. ② ③ ④
 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐材质的仪器有玻璃棒、 、 ;其中玻璃棒的作用是 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是 。
(3)已知Ksp(CuS)=8.4×1045,Ksp(NiS)=1.4×1024;在除铜镍的过程中,当Ni2+恰好完全沉淀时[此时溶液中c(Ni2+)=1.0×105mol·L1],溶液中Cu2+的浓度是 mol·L1。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式 。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是__________(填编号)。
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过 (填操作名称)制得硫酸锰晶体(MnSO4·H2O,相对分子质量为169)。已知废气中SO2浓度为8.4 g·m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得硫酸锰晶体质量为 kg (结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙醇和乙酸是生活中的常见有机物,回答下列问题:
①乙醇分子的官能团是羟基,请写出羟基的电子式:___________;
②一定条件下,乙酸能与乙醇发生反应成一种具有香味的油状液体,该有机反应方程式是________________________________________;该反应类型为___________;
(2)苯是一种重要的化工原料,也是一种重要的溶剂。请回答下列问题:
①把苯加入到盛有碘水的试管中,充分振荡、静置,可以观察到的现象是______________________;
②把苯加入到盛有少量酸性高锰酸钾溶液的试管中,振荡后,酸性高锰酸钾溶液不褪色,说明苯分子中__________(填“有”或“没有”)碳碳双键;
③在浓硫酸作用下,苯在50~60℃可以与浓硝酸反应生成硝基苯,浓硫酸除了吸水外还有一个作用是__________,反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两组热化学方程式中,有关△H的比较正确的是( )
①CH4(g)+O2(g)=CO2(g)+2H2O(g) △H1
CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H2
②NaOH(aq)+![]() H2SO4(浓)=
H2SO4(浓)=![]() Na2SO4(aq)+H2O(1) △H3
Na2SO4(aq)+H2O(1) △H3
NaOH (aq)+CH3 COOH( aq)=CH3COONa( aq)+H2O(1) △H4
A. △Hl>△H2,△H3>△H4, B. △HI>△H2,△H3<△H4
C. △H1=△H2,△H3=△H4 D. △Hl<△H2,△H3<△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭的容器中的一定量混合气体发生反应,xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.80mol/L,保持温度不变,将容器的容器扩大到原来的两倍,在达平衡时,测得A的浓度降低为0.5 mol/L.下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.80mol/L,保持温度不变,将容器的容器扩大到原来的两倍,在达平衡时,测得A的浓度降低为0.5 mol/L.下列有关判断正确的是
A. x+y<z B. 平衡向正反应方向移动 C. B的转化率升高 D. C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的一组离子是
A.Ag+、Ca2+、Cl-、Br- B.I-、H+、SO42-、 ClO-
C.Al3+、NH4+、Cl-、CO32- D.K+、Mg2+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由工业级碳酸锂(含有少量碳酸镁等杂质)制备高纯碳酸锂。实验过程如下:

(1)实验室中在下图所示装置中进行碳化反应:

①碳化反应的主要反应离子方程式为 。
②碳化时温度需控制在30℃,可采取的措施是 。
温度不宜过高的原因是 。
(2)用CO2调pH为8—9,其目的是 。
(3)已知在不同温度下蒸发分解碳酸锂的产率与溶解度关系如图:

90℃以下,随温度升高,碳酸锂产率升高的原因可能是 。
(4)请补充完整由滤液制备高纯碳酸锂的实验方案:取滤液放置于烧杯中 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A. Na+、H+、Cu2+、NO3- B. Na+、Fe2+、H+、NO3-
C. NH4+、Cl-、SO42-、OH- D. HCO3-、NH4+、Na+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是
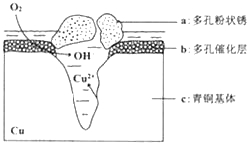
A.腐蚀过程中,负极是c
B.正极反应是 O2+4e+2H2O==4OH
C.若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224 L(标准状况)
D.环境中的Cl扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH+Cl==Cu2(OH)3Cl↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com