
(12分)黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1) 利用黄铜矿冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
① 反应中被还原的元素是________(填元素符号),
② 生成1 mol Fe2O3时转移电子的物质的量为________mol。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用过量稀盐酸浸取炉渣,过滤。②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
A.①中过滤的目的是____________________,
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为____________________。
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:
稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
① 所选试剂为_
② 证明炉渣中含有FeO的实验现象为
(共12分)
(1)①Cu、O (2分)(漏写得1分,写错不得分) ② 50 (2分)
(2)A.除去SiO2 (2分)
B.H2O2+2Fe2++2H+===2Fe3++2H2O (2分)
C.①稀硫酸、KMnO4溶液,(2分)(漏选得1分,错选不得分)
②稀硫酸浸取炉渣所得的溶液使KMnO4溶液褪色(2分)
【解析】
试题分析:(1)①氧化还原反应中化合价降低的元素被还原,该反应中Cu元素由+2价降低为0,O元素由0降低为-2价,所以被还原的元素为:Cu、O。
②根据8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2可知, Cu元素由+2价降低为0,O元素由0降低为-2价,则对应关系为2Fe2O3 ~8CuFeS2 ~100e?,所以生成1 mol Fe2O3时转移电子的物质的量为50mol。
8Cu+4FeO+2Fe2O3+16SO2可知, Cu元素由+2价降低为0,O元素由0降低为-2价,则对应关系为2Fe2O3 ~8CuFeS2 ~100e?,所以生成1 mol Fe2O3时转移电子的物质的量为50mol。
(2)A.用过量稀盐酸浸取炉渣,剩余的固体为SiO2,所以①中过滤的目的是:除去SiO2
B.H2O2在酸性条件下,把Fe2+氧化为Fe3+,离子方程式为:H2O2+2Fe2++2H+===2Fe3++2H2O
C.①若验证炉渣中含有FeO,首先加入稀硫酸,与FeO反应生成Fe2+,再用KMnO4溶液检验Fe2+,所选试剂为:稀硫酸、KMnO4溶液;Fe2+被KMnO4氧化,能使KMnO4溶液褪色,所以证明炉渣中含有FeO的实验现象为:稀硫酸浸取炉渣所得的溶液使KMnO4溶液褪色。
考点:本题考查氧化还原反应原理、实验基本操作、实验方案的设计与分析、离子方程式的书写。


科目:高中化学 来源:2015届福建省四地六校高三上学期第一次月考化学试卷(解析版) 题型:填空题
(13分) N元素有多种化合物,它们之间可以发生转化,如:N2H4+HNO2=2H2O+HN3。请回答下列问题:
(1)N与O电负性较大的是 。
(2)NaN3的晶体类型是 。
(3)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是 。
(4)N2H4中的N原子的杂化类型是 。
(5)NO2-离子是一种很好的配位体,能提供孤电子对是 。
A.氧原子 B.氮原子 C.两者都可以
NO2-与钴盐通过配位键形成的[Co(NO2)6]3-能与K+离子结合生成黄色K3[Co(NO2)6]沉淀,此方法可用于检验溶液中的K+离子,写出该配合物中钴离子的电子排布式 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中化学试卷(解析版) 题型:选择题
某合作学习小组讨论辨析以下说法 ,其中说法正确的是
①纯碱和熟石灰都是碱;
②沼气和水蒸气都是可再生能源;
③冰和干冰既是纯净物又是化合物;
④硫酸和食醋既是化合物又是酸;
⑤不锈钢和目前流通的硬币都是合金;
⑥粗盐和酸雨都是混合物。
A.③⑤⑥ B.②④⑥ C.①③⑤ D.①②③⑥
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期半期联考化学试卷(解析版) 题型:选择题
用惰性电极实现电解,下列说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故需加NaOH固体才能恢复到原溶液
C.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
D.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期半期联考化学试卷(解析版) 题型:选择题
①4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2834.9 kJ·mol-1
②4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3119.1 kJ·mol-1
由此得出的正确结论是
A.等质量的O2比O3能量高,由O2变为O3为放热反应
B.等质量的O2比O3能量低,由O2变为O3为吸热反应
C.O3比O2稳定,由O2变为O3为吸热反应
D.O2比O3稳定,由O2变为O3为放热反应
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期半期联考化学试卷(解析版) 题型:选择题
某同学设计如下实验测量m g铜银合金样品中铜的质量分数:
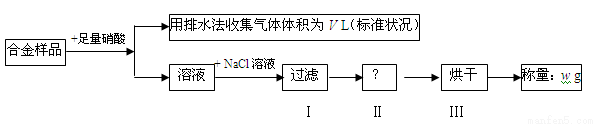
下列说法中不正确的是
A.收集到的V L气体全为 NO
B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒
C.操作Ⅱ应是洗涤
D.铜的质量分数为: ×100%
×100%
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期半期联考化学试卷(解析版) 题型:选择题
下列化学用语书写正确的是
A.熔融状态下NaHSO4电离方程式:NaHSO4=Na++H++SO42-
B.碳酸氢铵溶液中加入足量氢氧化钠:HCO + OH-=CO32-+ H2O
C.钠投入水中:2Na+2H2O=2Na++2OH-+H2↑
D.氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一上学期半期联考化学试卷(解析版) 题型:选择题
已知1L 0.1 mol/L的NaRO3溶液中含RO3-的质量为8.5克。在RO3-中,氧原子中质子数和中子数相等,R的中子数为20,则RO3-的核外电子总数为
A.40 B.42 C.44 D.46
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:选择题
下列实验中,所采取的分离方法与对应原理都正确的是 ( )
选项 | 目的 | 分离方法 | 原理 |
A. | 分离氢氧化铁胶体和氯离子 | 盐析 | 胶体不能透过半透膜,离子能 |
B. | 分离植物油和水的混合物 | 分液 | 二者互不相溶且密度不同 |
C. | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
D. | 除去乙醇中的乙酸 | 蒸馏 | 乙醇与乙酸沸点相差较大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com