
海水是宝贵的自然资源.利用海水水可以得到一系列产品.也可以进行废气处理。
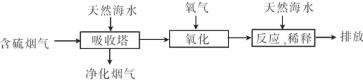
(1)利用氯碱工业产品处理含SO2的烟气的流程如下:
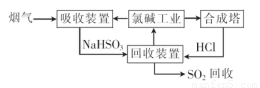
①“吸收装置”中发生反应的离子方程式是??????????????????? .
②上述流程中循环利用的物质是??????????????? 。
(2)利用海水脱硫可以有效地解决煤燃烧排放的SO2造成的一系列环境问题。其工艺流程如图所示:
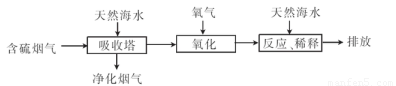
天然海水吸收含硫的烟气后.需要用氧气进行氧化处理.其反应原理的化学方程式是????????? ;氧化后的海水需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是???????? 。
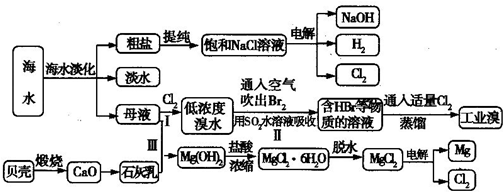
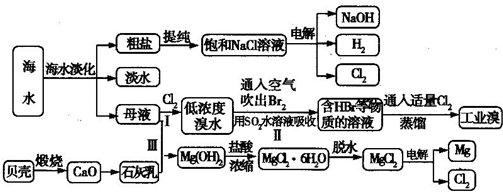
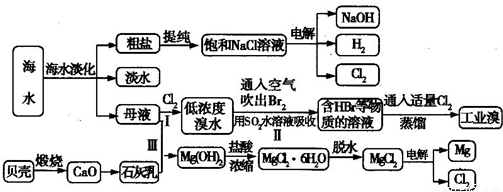
(3)从海水中捉纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子.对母液进行一系列的加工可制得金属镁。
①从离子反席的角度思考.在母液中加入石灰乳所起的作用是????????????? 。
②要利用MgCl2·6H2O制得尢水氯化镁.应采取的措施是????????????? 。
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁.下列物质中可以用作镁蒸气的冷却剂的是?????? (填字母)。
A.Ar??? B.CO2???? C 空气???? D.O2??? E.水蒸气
(1)①SO2+OH-=HSO?? ②NaCl
(2)2H2SO3+O2=2H2SO4;氢氧化钠与硫酸发生中和反应
(3)①沉淀Mg2+[或制取Mg(OH) 2]? ②在HCl气流中脱水,抑制MgCl2水解??? ③A
【解析】
试题分析:(1) ①氯碱工业反应的化学方程式为:2NaCl+H2O 2NaOH+H2↑+Cl2↑.溶液的主要成分是NaOH。将含SO2的烟气通入该溶液时发生反应:SO2+2NaOH=Na2SO3+H2O ;SO2过量时发生SO2+NaOH=NaHSO3。相应的离子方程式为:SO2+2OH-=SO32-+H2O;SO2+OH-=HSO3-。②由流程图可以看出:在上述流程中循环利用的物质是NaCl。(2)用氧气进行氧化处理吸收含硫的烟气后天然海水的反应原理的化学方程式是2H2SO3+O2=2H2SO4;氧化后的海水含有硫酸,水溶液显酸性,所以需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是使氢氧化钠与硫酸发生中和反应。(3)①在母液中加入石灰乳所起的作用是使Mg2+转化为Mg(OH) 2沉淀除去。②MgCl2是强酸弱碱盐,加热时盐会弱碱在结晶水中,盐发生水解反应产生Mg(OH) 2和HCl,HCl随着水分的蒸发而挥发,最后得到的是Mg(OH) 2固体。元素要利用MgCl2·6H2O制得无水氯化镁.应采取的措施是在HCl气流中脱水,来抑制MgCl2水解。③由于Mg活动性很强,在高温时容易与空气中的O2 及水蒸气发生反应,也能与CO2发生反应产生MgO和C。所以要在惰性气体Ar的环境中冷却。选项为A。
2NaOH+H2↑+Cl2↑.溶液的主要成分是NaOH。将含SO2的烟气通入该溶液时发生反应:SO2+2NaOH=Na2SO3+H2O ;SO2过量时发生SO2+NaOH=NaHSO3。相应的离子方程式为:SO2+2OH-=SO32-+H2O;SO2+OH-=HSO3-。②由流程图可以看出:在上述流程中循环利用的物质是NaCl。(2)用氧气进行氧化处理吸收含硫的烟气后天然海水的反应原理的化学方程式是2H2SO3+O2=2H2SO4;氧化后的海水含有硫酸,水溶液显酸性,所以需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是使氢氧化钠与硫酸发生中和反应。(3)①在母液中加入石灰乳所起的作用是使Mg2+转化为Mg(OH) 2沉淀除去。②MgCl2是强酸弱碱盐,加热时盐会弱碱在结晶水中,盐发生水解反应产生Mg(OH) 2和HCl,HCl随着水分的蒸发而挥发,最后得到的是Mg(OH) 2固体。元素要利用MgCl2·6H2O制得无水氯化镁.应采取的措施是在HCl气流中脱水,来抑制MgCl2水解。③由于Mg活动性很强,在高温时容易与空气中的O2 及水蒸气发生反应,也能与CO2发生反应产生MgO和C。所以要在惰性气体Ar的环境中冷却。选项为A。
考点:考查煤燃烧排放的SO2造成的危害的治理方法及电解法冶炼Mg的有关问题的知识。


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2013年高考化学备考复习卷28:化学与技术(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com