
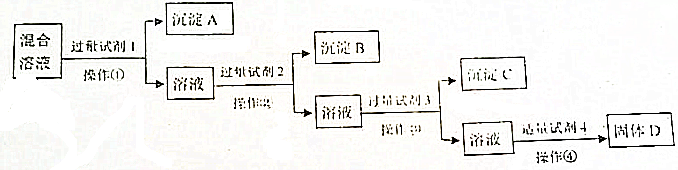
| A. | HCl | B. | CaCO3 | C. | H2O | D. | NaOH |
分析 HClO的电离常数小于H2CO3的第一级电离常数(Ka1)大于H2CO3的第二级电离常数(Ka2),说明酸性H2CO3>HClO>HCO3-,氯水中含有HCl和HClO,为了提高氯水中HClO的浓度,加入的物质应该和盐酸反应而和次氯酸不反应,根据强酸制取弱酸分析解答.
解答 解:HClO的电离常数小于H2CO3的第一级电离常数(Ka1)大于H2CO3的第二级电离常数(Ka2),说明酸性 H2CO3>HClO>HCO3-,氯水中含有HCl和HClO,为了提高氯水中HClO的浓度,加入的物质应该和盐酸反应而和次氯酸不反应,
A、加和盐酸,抑制氯气与水的反应,减小了次氯酸的浓度,故A错误;
B、根据酸性强弱知,加入CaCO3,盐酸与碳酸钙反应,促使氯气与水的反应正向进行,而次氯酸不与碳酸钙反应,次氯酸的浓度增大,故B正确;
C、加水溶液被稀释,次氯酸的浓度减小,故C错误;
D、氢氧化钠与盐酸和次氯酸都反应,所以次氯酸的浓度减小,故D错误;故选B.
点评 本题考查了弱电解质的电离,明确酸的电离平衡常数与酸性强弱之间关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用无磷洗衣粉,可彻底解决水体富营养化问题 | |
| B. | SO2是大气污染物,可以用生石灰除去工业废气中的SO2 | |
| C. | 明矾水解产生Al(OH)3胶体粒子,可除去悬浮物 | |
| D. | 使用清洁能源是防止酸雨发生的重要措施之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol CO2和CO混合气体含有的碳原子数为NA | |
| B. | 在KIO3+6HI═KI+3I2+3H2O反应中,每生成 3molI2,则转移6NA个电子 | |
| C. | 78gNa2O2与足量的CO2完全反应,转移的电子总数为NA | |
| D. | 在1L0.1mol-L-1 Na2S溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
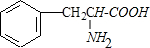 .
.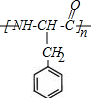 .
.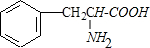 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$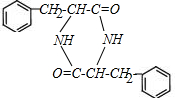 +2H2O;M与乙醇在浓硫酸、加热条件下发生反应的类型为酯化反应(取代反应).
+2H2O;M与乙醇在浓硫酸、加热条件下发生反应的类型为酯化反应(取代反应).查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 (填分子式),其原因是在双氧水分子中每个H原子和O原子形成一对共用电子对,O原子之间共用一对电子,这样每个原子都达到稳定结构.
(填分子式),其原因是在双氧水分子中每个H原子和O原子形成一对共用电子对,O原子之间共用一对电子,这样每个原子都达到稳定结构.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
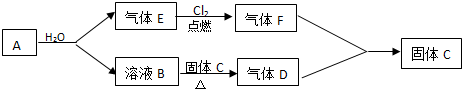
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com