
(9分)近期“五水共治”越来越引起人们的重视。对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含乙酸钠和对氯酚( )的废水可以通过构成微生物电池除去,其原理如下图所示。
)的废水可以通过构成微生物电池除去,其原理如下图所示。

①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。

①阳极的电极反应式为 ;
②简述浓缩室中得到浓乳酸的原理 ;
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL10 g/L 乳酸溶液通电一段时间后,浓度上升为 145 g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为 L(乳酸的摩尔质量为90g/ mol )。
(1) ①负 (1分) 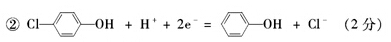
(2)①4OH- - 4e- = 2H2O + O2↑ (2分)
②阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室(1分);A-通过阴离子交换膜从阴极进入浓缩室,H++A— = HA,乳酸浓度增大(1分) ③ 6.72 (2分)
【解析】
试题分析:(1)①根据装置图可知氢离子向A电极移动,这说明A电极是正极,则B电极是负极。
②A极是正极,得到电子发生还原反应,则电极反应式为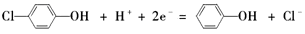 。
。
(2)①电解池中阳极失去电子发生氧化反应,阳极加入硫酸,则溶液中的氢氧根离子放电,电极反应式为4OH- - 4e- = 2H2O + O2↑。
②阳极OH-放电,导致溶液中c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,二者结合生成HA,即H++A—=HA,从而导致乳酸浓度增大。
③反应后增加的乳酸质量是0.4L×(145g/L—10g/L)=54g,物质的量是54g÷90g/mol=0.6mol,因此结合氢离子的物质的量是0.6mol,根据电荷守恒可知生成的氢气是0.3mol,在标准状况下的体积是6.72L。
考点:考查电化学原理的应用


科目:高中化学 来源:2014-2015学年河南省天一高三上学期大联考化学试卷(解析版) 题型:选择题
W、X、Y、Z是核外电子层数相同且原子序数依次增大的短周期元素,W、X是金属元素,Y的氢化物为H2Y,Z的某种含氧酸有漂白性。W、X的最高价氧化物对应的水化物可以发生反应生成盐和水。下列判断正确的是
A.X的金属性强于W的金属性
B.W、X分别与Z形成的化合物都是离子化合物
C.W、X、Y、Z的简单离子的半径:Y>Z>W>X
D.Y的氧化物通入含有Z单质的溶液中,一定无明显变化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三上学期期末理综化学试卷(解析版) 题型:推断题
(14分)A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,B是短周期中金属性最强的元素,C是同周期中阳离子半径最小的元素,D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,E的最外层电子数与内层电子数之比为3﹕5。请回答:
(1)D的元素符号为 。
(2)F在元素周期表中的位置 。
(3)用电子式表示元素B与元素F形成的化合物: 。
(4)B单质与氧气反应的产物与C的单质同时放入水中,产生两种无色气体,有关的化学方程式为 、 。
(5)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为 。
(6)某混合物的稀溶液中,只可能含有B、C、F构成的简单离子或A、E的最高价氧化物对应水化物所电离出来的阴离子。现分别取一定体积的该溶液进行实验。两次每次取200.00mL进行实验。
实验1:取2mL溶液,向其中加入AgNO3溶液有沉淀产生;
实验2:取200mL溶液,向其中加入足量BaCl2溶液后,得干燥沉淀12.54g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g。请回答:
①根据以上实验,不能判断是否存在的离子有 。
② B的简单离子是否存在 ;若存在,浓度至少为 mol/L(若不存在,则不必回答第二问)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
关于下列装置的说法正确的是
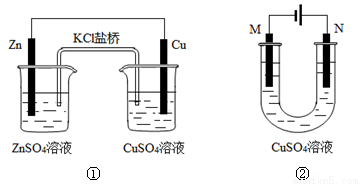
A.装置①中盐桥内的K+移向CuSO4溶液
B.装置①将电能转变为化学能
C.若装置②用于铁棒镀铜,则N极为铁棒
D.若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
下列说法正确的是
A.2-甲基丙烷的一氯取代物有两种
B. 和
和 互为同系物
互为同系物
C.顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同
D. 的名称为2-甲基-3-乙基丁烷
的名称为2-甲基-3-乙基丁烷
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:选择题
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g) + 5O2 (g)  4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1?K= 1.1×1026?
4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1?K= 1.1×1026?
② 4NH3 (g) + 4O2 (g)  2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1?K= 4.4×1028
2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1?K= 4.4×1028
③ 4NH3 (g) + 3O2 (g)  2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1?K= 7.1×1034
2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1?K= 7.1×1034
其中,②、③是副反应。若要减少副反应,提高NO的产率,最合理的措施是
A.减小压强 B.降低温度
C.增大O2浓度 D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:选择题
阅读下列短文:不同的卤素之间可以相互结合形成一系列的化合物。这类化合物称为卤素互化物。卤素互化物具有很高的化学活性,它们有许多化学性质跟卤素单质相似,例如:能跟大多数金属起反应生成相应的卤化物,也能跟某些非金属单质起反应生成相应的卤化物。溴化碘(IBr)是卤素互化物的一种。这种化合物在常温下是深红色的固体,熔点为41℃,沸点为116℃。下列对IBr的各种描述中,不正确的是
A.在很多化学反应中,溴化碘是一种氧化剂
B.固体溴化碘是一种原子晶体
C.与水能反应:IBr + H2O=HBr+ HIO
D.在Fe3+的催化下可与苯反应生成 和HBr
和HBr
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省红河州高三统一检测理综化学试卷(解析版) 题型:填空题
(14分,每空2分)四种短周期元素A、B、C、D的性质或结构信息如下。
①原子半径大小:A>B>C>D
②四种元素之间形成的某三种分子的比例模型及部分性质如下:

请根据上述信息回答下列问题。
(1)C元素在周期表中的位置 , 请写出D2C2分子的结构式________,A元素的单质与物质甲发生反应的离子方程式_______。
(2)丁物质与乙互为同系物,在相同条件下其蒸气的密度是氢气密度的36倍,且核磁共振氢谱只有
1组峰,写出丁物质的结构简式 。
(3)A与同周期的E元素组成的化合物EA5在热水中完全水解生成一种中强酸和一种强酸,该反应的化学方程式是 。
 (4)以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,该同学想在装置Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式 ,一段时间后,测得铁增重128g,此时b极通入气体的体积是 L(标准状况下)。
(4)以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,该同学想在装置Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式 ,一段时间后,测得铁增重128g,此时b极通入气体的体积是 L(标准状况下)。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
25℃时,0.1mol/L下列溶液的pH如下表,有关比较错误的是
序 号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸的强度:HF>H2CO3
B.由水电离产生的c(H+):①=②
C.溶液中离子的总浓度:①>③
D.④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3) 0.1 mol/L
0.1 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com