
【题目】下列说法不正确的是( )
A.Fe2O3可用作红色颜料B.浓H2SO4可用作干燥剂
C.可用SiO2作半导体材料D.NaHCO3可用作焙制糕点
科目:高中化学 来源: 题型:
【题目】正丁烷和异丁烷是同分异构体的依据是
A. 具有相同的物理性质
B. 具有相似的化学性质
C. 具有相同的空间构型
D. 分子式相同但碳原子连接方式不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些电镀厂的酸性废水中常含有一定量的CrO42-和Cr2O72-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法,该法的工艺流程为:
![]()
(1)其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,若平衡体系的pH=12,该溶液显_____色。能说明第①步反应达平衡状态的是______。
Cr2O72-(橙色)+H2O,若平衡体系的pH=12,该溶液显_____色。能说明第①步反应达平衡状态的是______。
a.Cr2O72-和CrO42-的浓度相同 b.溶液的pH值不变
c.溶液的颜色不变 d.2v(Cr2O72-)=v(CrO42-)
(2)写出第②步的离子反应方程式:__________。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法:该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)写出阳极的电极反应式___________________。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释)___________,溶液中同时生成的沉淀还有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C是所在周期原子半径最大的主族元素,A和B、D、E均能形成共价型化合物。A和B、C和E形成的化合物在水中均呈碱性.回答下列问题:
(1)元素D在周期表中的位置____________,其氢化物的结构式是___________;
(2)B、C、E三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)___________;
(3)A分别与B、E形成的化合物可以相互反应,写出生成的正盐的电子式_____________;
(4)A、B和E个数比为5:1:1形成的化合物中存在的化学键类型为___________,其与足量的氢氧化钠溶液反应的离子方程式为______________________________;
(5)C和E形成的化合物在水中呈碱性的原因(用离子方程式表示)是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+)

常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.3 | 3.7 | 4.7 | --- |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 6.7 | 9(>9 溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是____________________(至少写一条)。
(2)加入H2O2 目的是氧化_______离子,其有关的离子方程式______________________。针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(3)调pH=8是为了将_____________离子(从Fe3+、Al3+、Cu2+、Mg2+中选择)以氢氧化物沉淀的形式除去。滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,其有关的离子方程式是_____________________________________,取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀, 其有关的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如表:
元素 | 相关信息 |
X | X的基态原子L层电子数是K层电子数的2倍 |
Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
Z | Z是第三周期电负性最大的元素 |
W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第周期第族,其基态原子最外层有个电子 .
(2)X的电负性比Y的(填“大”或“小”),XY2的价层电子对模型为 .
(3)X和Y的简单气态氢化物中,较稳定的是 , 沸点较高的是(写化学式) .
(4)化合物XYZ2中σ键和π键个数比为 .
(5)写出与W同周期且导电性强于W的某元素价电子排布式. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜品醇可作为消毒剂、抗氧化剂、医药和溶剂,其结构简式如图所示.下列说法正确的是( ) 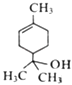
A.萜品醇的分子式为C9H10O
B.萜品醇能发生加成反应和取代反应
C.萜品醇能被高锰酸钾被和溴水氧化
D.1mol萜品醇最多与3mol H2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过下列两步实验测定草酸晶体(H2C2O4·xH2O)中结晶水x的值:
①称取2.52 g草酸晶体,配制成100 .00 mL溶液。
②取25.00 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为0.100 mol·L-1 KMnO4溶液进行滴定。其反应原理是:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
(1)实验②中,KMnO4应装在______滴定管中(填“酸式”、“碱式”)。
(2)如图表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积______。
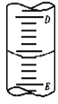
A.是amL B.是(50-a)mL
C.一定大于amL D.一定大于(50-a)mL
(3)判断达到滴定终点的现象是_____________________________;
若滴定终点时,共用去KMnO4溶液20.00 mL,则x =__________。
(4)若在滴入KMnO4溶液之前滴定管的尖嘴部分有气泡,滴定结束后气泡消失,则会使测定结果______(偏高、偏低或无影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com