
| A. | 根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不与浓硫酸发生反应 | |
| B. | 过氧化钠可作为防毒面具和潜水艇内的供氧剂 | |
| C. | 可用稀硝酸鉴别铜锌合金制成的假金币 | |
| D. | 氢氟酸可用于雕刻玻璃 |
分析 A.浓硫酸具有强的氧化性,常温下能够使铝发生钝化;
B.过氧化钠与水、二氧化碳反应生成氧气;
C.硝酸与铜、锌都能发生反应,与金不反应;
D.玻璃 中含有二氧化硅,能够与氢氟酸反应.
解答 解:A.浓硫酸具有强的氧化性,常温下能够使铝发生钝化,生成致密氧化膜阻止反应进行,该过程属于化学反应,故A错误;
B.过氧化钠与水、二氧化碳反应生成氧气,所以可以做供氧剂,故B正确;
C.硝酸与铜、锌都能发生反应,与金不反应,故C正确;
D.玻璃 中含有二氧化硅,能够与氢氟酸反应生成四氟化硅和水,所以氢氟酸能够腐蚀玻璃,雕刻玻璃,故D正确;
故选:A.
点评 本题考查了元素化合物知识,熟悉浓硫酸、过氧化钠、硝酸、二氧化硅的性质是解题关键,题目难度不大,注意钝化属于化学反应,题目难度不大.


科目:高中化学 来源: 题型:解答题
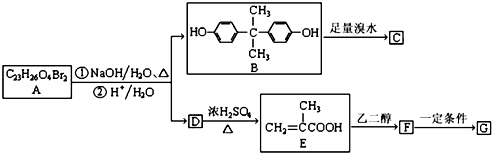
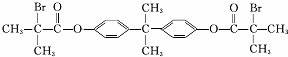
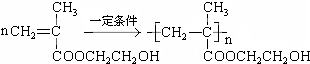 .
.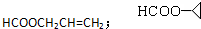 .
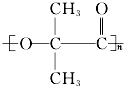
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知1molSO2(g)生成1molSO3(g)的能量变化如图所示,回答下列问题:
(1)已知1molSO2(g)生成1molSO3(g)的能量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
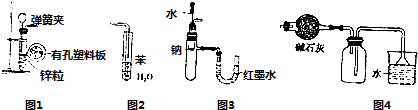
| A. | 用图1所示装置制取少量H2 | |
| B. | 用图2所示装置吸收氨气以防止倒吸 | |
| C. | 用图3所示装置验证Na和水反应的热效应 | |
| D. | 用图4所示装置可用于干燥、收集氯化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
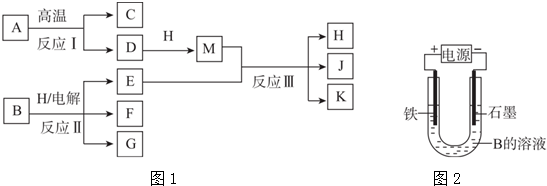
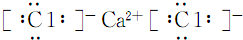 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
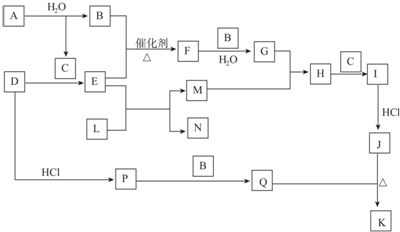
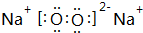 ,D的化学式(NH4)2S.
,D的化学式(NH4)2S.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com