
分析 (1)反应方程式为:Fe+2HCl=FeCl2+H2↑,Zn+2HCl=ZnCl2+H2↑,设出铁、锌的物质的量,分别根据总质量、生成氢气的物质的量列式计算;
(2)根据反应可知,消耗HCl的物质的量是生成氢气物质的量的2倍,据此计算出消耗HCl的物质的量.
解答 解:n(H2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,设混合物中含有xmolFe、ymolZn,
反应方程式为Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑,则
Fe+2HCl=FeCl2+H2↑
1 2 1
x 2x x
Zn+2HCl=ZnCl2+H2↑
1 2 1
y 2y y
(1)由以上反应方程式可得:$\left\{\begin{array}{l}{56x+65y=12.1}\\{x+y=0.2}\end{array}\right.$,
解得:$\left\{\begin{array}{l}{x=0.1}\\{y=0.1}\end{array}\right.$,
m(Fe)=0.1mol×56g/mol=5.6g,
w(Fe)=$\frac{5.6g}{12.1g}$=46.3%,
答:原混合物中Fe的质量分数为46.3%.
(2)生成氢气来自消耗HCl中的氢元素,根据H元素守恒可知:n(HCl)=2n(H2)=0.2mol×2=0.4mol,
答:消耗HCl的物质的量为0.4mol.
点评 本题考查化学方程式的计算,题目难度不大,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| 已 知 | 类 推 | |
| A | 将铁粉投入稀硫酸中 Fe+H2SO4(稀)=FeSO4+H2↑ | 将铁粉投入稀硝酸中 Fe+2HNO3(稀)=Fe(NO3)2+H2↑ |
| B | 铝热法炼铁 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | 铝热法炼镁 2Al+3MgO$\frac{\underline{\;高温\;}}{\;}$3Mg+Al2O3 |
| C | 将乙烯通入溴水中 CH2=CH2+Br2→CH2BrCH2Br | 将丙烯通入溴水中 CH3CH=CH2+Br2→CH3CHBrCH2Br |
| D | 乙烯在适当条件下制聚乙烯 nCH2=CH2 $→_{加热、加压}^{催化剂}$ 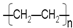 | 丙烯在适当条件下制聚丙烯 nCH3CH=CH2 $→_{加热、加压}^{催化剂}$  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、W、R五种元素位于元素周期表前四周期,它们的原子序数依次增大
X、Y、Z、W、R五种元素位于元素周期表前四周期,它们的原子序数依次增大| 元素 | 相关信息 |
| X | 原子核外的价电子排布式为nsnnp2n |
| Y | 元素周期表中电负性最强的元素 |
| Z | Z与W位于同周期,且最外层有两个未成对电子 |
| w | 单质为淡黄色固体,能在火山口发现 |
| R | 原子的基态未成对电子致是同周期最多的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与硝酸 | B. | 澄清的石灰水与CO2 | ||
| C. | Na与O2 | D. | AlCl3与氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组合序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ |
| 组合数据 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.04mol/(L•s) | ||
| C. | v(C)=0.03mol/(L•s) | D. | v(D)=0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com