
| A.该元素原子最外层共有3个电子 |
| B.该元素位于第5周期ⅡA族 |
| C.该元素原子核外第N层上共有9个不同状态的电子 |
| D.该元素原子第四电子层上有5个空轨道 |
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱金属单质均为银白色,密度均小于水 |
| B.碱金属单质从Li到Cs,熔点依次升高 |
| C.氢氧化铯碱性强于氢氧化钠 |
| D.碱金属元素形成的阳离子,从Li+到Cs+氧化性依次增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.A可能在第3周期ⅥA族 | B.B+离子半径大于A2–离子半径 |
| C.A的电负性大于B的电负性 | D.A的第一电离能小于B的第一电离能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
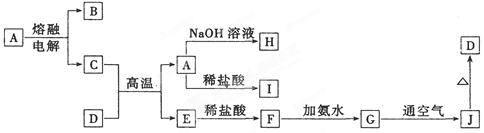
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
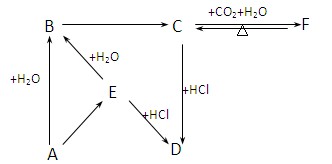
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com