
【题目】元素周期表中的28号元素Ni有重要的用途,它有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面也有广泛应用。工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:
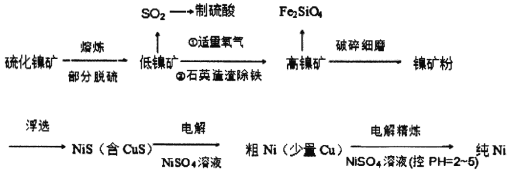
已知:电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2-2e-=2H+ E=0.00V Cu-2e-=Cu2+ E=0.34V
Fe-2e-=Fe2+ E=-0.44V Ni-2e-=Ni2+ E=-0.25V
(1)镍在周期表中的位置为_______________________________。
(2)高镍矿破碎细磨的作用______________________________________。
(3)焰色反应实验可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是______________________。
(4)造渣除铁时发生的化学反应方程式___________________________________(产物以氧化形式表示)。
(5)电解制粗镍时阳极发生的主要电极反应式_____________________________________。
(6)工业上由NiSO4溶液制得Ni(OH)2后,再滴加NaC1O溶液,滴加过程中发生反应的离子方程式为_________________________________________________________。
(7)电解精炼镍的过程需控制pH为2~5,试分析原因______________________________,阳极泥的成分为________________(写名称)。
【答案】第四周期Ⅷ族 增大接触面积,提高浮选率 镍的焰色反应呈无色,不影响其他金属元素的焰色 2FeO+SiO2 ![]() 2FeOSiO2 NiS-2e-=Ni2++S 2Ni(OH)2+ClO-+H2O=2Ni(OH)3+Cl-( 2Ni(OH)2+ClO-+OH-=2NiO (OH) +Cl--+H2O) pH<2时,c(H+)大,容易在阳极放电;pH>5时,c(OH-)大,镍离子容易沉淀 铜
2FeOSiO2 NiS-2e-=Ni2++S 2Ni(OH)2+ClO-+H2O=2Ni(OH)3+Cl-( 2Ni(OH)2+ClO-+OH-=2NiO (OH) +Cl--+H2O) pH<2时,c(H+)大,容易在阳极放电;pH>5时,c(OH-)大,镍离子容易沉淀 铜
【解析】
根据金属元素在电解过程的中放电顺序分析电解反应。
(1)镍是28号元素,根据电子排布规律分析,其在第四周期Ⅷ族;
(2)高镍矿破碎细磨是为了增大接触面积,提高浮选率;
(3)焰色反应实验是观察某些金属元素灼烧时的颜色,可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,说明镍的焰色反应呈无色,不影响其他金属元素的焰色;
(4)根据流程分析,硫化亚铁在溶炼时转化为FeO和SO2,加入二氧化硅除铁时,FeO转化为Fe2SiO4,故方程式为:2FeO+SiO2 ![]() 2FeOSiO2;
2FeOSiO2;
(5)电解制粗镍时,阳极上硫化镍失去电子生成镍离子和硫,阴极是镍离子得到电子生成镍单质,阳极反应为:NiS-2e-=Ni2++S;
(6)Ni(OH)与 NaC1O溶液发生氧化还原反应,镍元素化合价升高为+3价,氯元素化合价降低到-1价,根据电子守恒和质量守恒得方程式为:2Ni(OH)2+ClO-+H2O=2Ni(OH)3+Cl-或2Ni(OH)2+ClO-+OH-=2NiO (OH) +Cl--+H2O;
(7电解硫酸镍溶液时需要考虑离子的放电顺序,当氢离子浓度较大时是氢离子放电不是镍离子放电,即pH<2时,c(H+)较大,容易在阳极放电;但当溶液的酸性很弱时,即pH>5时,c(OH-)较大,镍离子容易沉淀。由电极电位的数据可知,镍比铜活泼,电解精炼时,阳极上镍失去电子,铜不能失去电子,铜转化为阳极泥。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有机物I是一种医药合成中间体,实验室以芳香烃A为原料制备I的路线如图(部分反应条件已省略):

已知:RCH=CH2+HBr![]() RCH2CH2Br。
RCH2CH2Br。
回答下列问题:
(1)X的分子式为C8H8,且X与A互为同系物,则X的化学名称是___。
(2)B生成C的反应类型是___,B、C含有的相同的官能团名称是___。
(3)碳原子上连有4个不同原子或基团时,该碳原子为手性碳原子。写出D的结构简式,并用星号(*)标出其中的手性碳原子___。
(4)设计实验检验有机物E中的含氧官能团:___。
(5)G的结构简式是___。
(6)Y与C是同分异构体,Y中含苯环,且苯环上有2个取代基,Y能发生银镜反应,其核磁共振氢谱中有5组峰,且峰面积之比为6:2:2:1:1,则Y的结构简式为___。
(7)丙二酸(HOOCO2COOH)主要用作医药合成中间体、电镀抛光剂等。设计以丙烯(CH3CH=CH2)和 为原料制备丙二酸的合成路线:___(无机试剂任选)。
为原料制备丙二酸的合成路线:___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物具有抗癌抑菌活性,其结构如图所示,下列关于该有机物说法正确的是( )

A.该有机物可以使溴水、酸性高锰酸钾溶液褪色,遇FeCl3溶液会显紫色
B.该有机物结构中含5个手性碳原子
C.1mol该有机物最多和4molH2反应
D.1mol该有机物最多消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活污水中的氮和磷主要以铵盐和磷酸盐形式存在,可用铁、石墨作电极,用电解法从溶液中去除。电解时:如图1原理所示可进行除氮,有Cl-存在时,主要依靠有效氯(HClO、ClO-)将NH4+或NH3氧化为N2;翻转电源正负极,可进行除磷,原理是利用Fe2+将PO43-转化为Fe3(PO4)2沉淀。图2为某含Cl-污水在氮磷联合脱除过程中溶液pH的变化。下列说法正确的是( )

A.电解法除氮有效氯HClO氧化NH4+的离子方程式为3HClO+2NH4+=3Cl-+N2↑+3H2O+5H+
B.溶液pH越小有效氯浓度越大,氮的去除率越高
C.图2中20~40min脱除的元素是磷元素,此时阴极电极反应式为2H++2e-=H2↑
D.图2中0~20min脱除的元素是氮元素,此时铁作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某浓度H2A溶液中滴加NaOH溶液,若定义pC=﹣lgC,则测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是( )
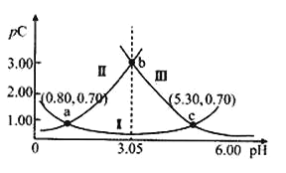
A.曲线II表示pC(HA-)随pH的变化
B.常温下,![]() =104.50
=104.50
C.将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
D.a、b、c三点对应的溶液,c(HA-)+c(A2-)+c(HA)始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氢化合物又称为烃,烃分为饱和烃和不饱和烃两大类。完成下列填空:
(1)能与乙烯发生加成反应的物质是_______(填写编号)。
a. 溴水 b. 氧气 c. 氯化氢 d. 酸性高锰酸钾溶液
(2)与乙烯和氢气的加成产物互为同系物的是________(填写编号)。
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]()
(3)请写出乙烯相邻同系物的加聚反应方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定硫酸铜晶体(![]() )中x值的实验过程如下:
)中x值的实验过程如下:

(1)从下列仪器中选出所需仪器(用标号字母填写)_______________________。
A. 电子天平 B. 试管夹 C. 酒精灯 D. 蒸发皿 E. 坩埚 F. 石棉网
(2)恒重操作时,连续两次称量的结果相差不超过_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. CHCl3+HF → CHFCl2+HCl 属于取代反应
B. 煤气化生成 CO 和H2,再经过催化合成可以得到甲醇等液体燃料
C. 石油裂解气和SO2 都能使 KMnO4 溶液褪色,褪色原理不同
D. 苯在一定条件下能与H2 发生加成反应,也能与氯气发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com