
【题目】下列叙述中不正确的是( )
A.第ⅠA族的金属元素是同一周期中金属性最强的元素
B.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
C.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
D.主族元素原子的最外层电子数不一定等于该元素的最高正化合价
科目:高中化学 来源: 题型:
【题目】H2S 为二元弱酸,20 ℃的 pKa1=6.89,pKa2=14.15(电离常数 K 的负对数-lg K=pK)。在20 ℃时,向 0.1 mol·L1 的 Na2S 溶液中缓慢通入 HCl(忽略溶液体积变化和 H2S 的挥发),在该过程中下列微粒物质的量浓度关系一定正确的是
A.溶液中 c(HS-)=c(S2-)时,c(S2-)+2c(H2S)<c(Cl-)
B.溶液呈中性时,c(HS- )+c(H2S)=c(Cl- )
C.溶液 pH=6.89 时,c(Cl- )>c(HS- )=c(H2S)>c(H+)>c(OH-)
D.溶液中 c(Cl-)=0.2 mol·L-1 时,c(OH-)+c(HS- )+c(S2-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如下:
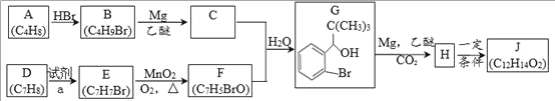
已知:R-Br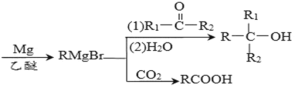
(1) A 的名称是_____,A分子中最多有_____个原子共平面。
(2) B 生成 A 的化学方程式_____。
(3) D 生成 E 的反应类型为_____
(4) F 的结构简式_____。
(5) J是一种酯,分子中除苯环外还含有一个五元环。写出 H 生成 J 的化学方程式_____(注明反应条件)。
(6)E![]()
![]() X,X 的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有_____种,写出其中核磁共振氢谱有五组吸收峰的结构简式_____。
X,X 的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有_____种,写出其中核磁共振氢谱有五组吸收峰的结构简式_____。
(7)利用题中信息和所学知识,写出以甲烷和化合物 D 为原料,合成![]() 的路线流程图_____(其它试剂自选)
的路线流程图_____(其它试剂自选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示:
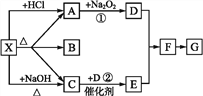
图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,请填写下列空白:
(1)物质X可以是______,C是_________, F是______。
(2)反应①的化学方程式是_________,反应②的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸(H2C2O4)为二元弱酸,25℃时,Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5。用NaOH溶液滴定草酸氢钾(KHC2O4)溶液,混合溶液的相对导电能力随加入NaOH体积的变化如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列有关描述中正确的是
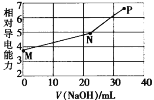
A.M点粒子浓度:c(K+)>c(![]() )>c(
)>c(![]() )>c(H2C2O4)
)>c(H2C2O4)
B.N点时存在:c(Na+)+c(K+)<2c(![]() )+2c(
)+2c(![]() )
)
C.从N点到P点的过程中溶液中一定存在:c(Na+)+c(H2C2O4)>c(![]() )
)
D.水的电离程度大小顺序:P>N>M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑料、橡胶等材料的交联剂F的合成路线如图所示:

已知:
回答下列问题:
(1)芳香族化合物A中官能团的名称为________________。
(2)C→D的反应类型是_______________,E的结构简式为________________。
(3)F与NaOH反应的化学方程式为___________________________________。
(4)F的同分异构体中符合下列条件的有______________(不考虑立体异构)种。
a.属于![]() 的二取代物
的二取代物
b.取代基处于对位且完全相同
c.含酯基且能发生银镜反应
其中核磁共振氢谱有4组峰,峰面积之比为6:2:1:1的结构简式为__________________(写出一种)。
(5)参照题干中合成路线,设计以丙酮为主要原料制备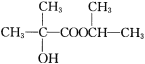 的合成路线(无机试剂任选)。________________________
的合成路线(无机试剂任选)。________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、M、N六种主族元素,它们在周期表中位置如图所示,下列说法正确的是( )
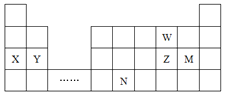
A.原子半径:![]() 简单离子半径:
简单离子半径:![]()
B.单质的还原性:![]() 简单氢化物的沸点:
简单氢化物的沸点:![]()
C.溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D.元素N位于金属与非金属的分界线附近,可以推断N的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经最新研究发现,NOx和SOx是形成雾霾天气的主要原因之一,因此研究NOx、SOx等大气污染物的妥善处理具有重要意义。
(1)为了消除NO造成的污染,通常采用一氧化碳和氢气进行催化还原NO。
已知:①N2(g)+O2(g)=2NO(g) ΔH=akJmol-1;
②2H2(g)+O2(g)=2H2O(l) ΔH=bkJmol-1;
③H2O(g)=H2O(l) ΔH=ckJmol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:________________________。
(2)目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:
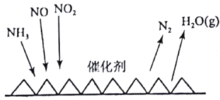
当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生反应。当有12mol电子发生转移时,则参与反应的NO2的物质的量为________。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/ | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①从0~2s该反应的平均速率v(NO2)=________mol/(Ls)。
②T1温度时,上述反应的化学平衡常数K=________。
③若将容器的温度改变为T2时其k正=k逆,则T1________T2(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
(4)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图。
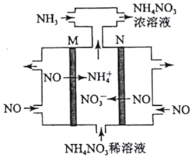
①N极的电极反应式为________________________。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,常温下H2S、H2CO3 的电离常数如下表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
(1)①常温下,0.1mol/L的硫化钠溶液和0.1mol.L-1的碳酸钠溶液,碱性更强的是_______。其原因是_____________________________。
② 常温下,硫化钠水解的离子方程式_____________________________。
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子。
①常温下,NaHS溶液显______(选填“酸性”、“中性”或“碱性”)
②常温下,向100 mL 0.1 mol·L-1 H2S溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是______________________________。
(3)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)_______________;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com