
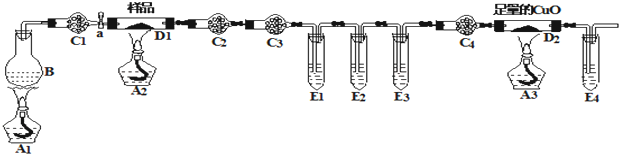
分析 草酸亚铁晶体(FeC2O4•nH2O)分解的实验探究:烧瓶B中盛有饱和NH4C1和饱和NaNO2的混合液,混合加热反应生成氮气、氯化钠和水,反应为:NH4Cl+NaNO2$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,制N2,利用氮气排除装置中的空气,避免空气中二氧化碳对实验造成干扰,减少误差,干燥管C1干燥氮气,结晶水合物分解生成水蒸气,干燥管C2中装有无水硫酸铜验证水蒸气存在,C3中盛装的试剂是P2O5或CaCl2,干燥生成的气体,E1中是澄清石灰水,生成沉淀证明生成二氧化碳,E2中装有氢氧化钠吸收二氧化碳,E3中装有澄清石灰水,验证气体中的CO2是否除尽,一氧化碳还原氧化铜反应生成二氧化碳通过装有澄清石灰水的E4,澄清石灰水变浑浊,证明一氧化碳生成.
(1)将充分反应后的固体残余物投入经煮沸的稀硫酸中溶解,固体完全溶解且无气体放出,说明无金属铁,取反应液加入KSCN溶液无血红色,证明无铁离子存在,分解生成的固体产物应为氧化亚铁;
(2)该装置中有3个酒精灯,先点A1生成氮气排装置中的空气,再点生成A2、A3,目的是实验结束把生成的产物全部赶到后面的装置充分反应,减少测定误差;
(3)该实验装置中有4个直立的试管,E1检验样品分解生成二氧化碳,E2吸收二氧化碳,E3检验CO2是否除尽,E4检验是否有一氧化碳生成;
(4)该实验装置中有4个干燥管,C3中盛装的试剂干燥生成的气体,据此选择试剂;
(5)测得硬质玻璃管D1中残余固体2.88g,上述分析判断为氧化亚铁的质量,得到铁元素物质的量,硬质玻璃管;D2中固体质量减轻0.64g是一氧化碳还原氧化铜反应前后质量变化,结合化学方程式计算费用的一氧化碳物质的量,结合元素守恒、质量守恒计算得到反应物和生成物物质的量之比,依据摩尔质量计算结晶水的数目,得到反应的化学方程式.
解答 解:(1)将充分反应后的固体残余物投入经煮沸的稀硫酸中溶解,固体完全溶解且无气体放出,说明无金属铁,取反应液加入KSCN溶液无血红色,证明无铁离子存在,分解生成的固体产物应为氧化亚铁,
故答案为:FeO;
(2)该装置中有3个酒精灯,先点A1加热烧瓶B一段时间,其目的是利用氮气排除装置中的空气,避免空气中二氧化碳对实验造成干扰,生成氮气排装置中的空气,然后停止加热,再点生成A2、A3,目的是实验结束把生成的产物全部赶到后面的装置充分反应,减少测定误差,
故答案为:3; A1;
(3)E1中是澄清石灰水,生成沉淀证明生成二氧化碳,E2中装有氢氧化钠吸收二氧化碳,E3中装有澄清石灰水,验证气体中的CO2是否除尽,一氧化碳还原氧化铜反应生成二氧化碳通过装有澄清石灰水的E4,澄清石灰水变浑浊,证明一氧化碳生成,
故答案为:验证气体中的CO2是否除尽;
(4)干燥管C1干燥氮气,结晶水合物分解生成水蒸气,干燥管C2中装有无水硫酸铜验证水蒸气存在,C3中盛装的试剂干燥生成的酸性气体,可选择P2O5或CaCl2,
故答案为:P2O5或CaCl2;
(5)上述实验分析,测得硬质玻璃管D1中残余固体2.88g,判断为氧化亚铁的质量,计算得到铁元素物质的量=$\frac{2.88g}{72g/mol}$=0.04mol,硬质玻璃管D2中固体质量减轻0.64g是一氧化碳还原氧化铜反应前后质量变化,结合化学方程式计算反应的一氧化碳物质的量,
CuO+CO=Cu+CO2,△m
1mol 16g
0.04 0.64g
结合元素守恒铁元素物质的量为0.04mol,7.2g样品物质的量为0.04mol,摩尔质量=$\frac{7.2g}{0.04mol}$=180g/mol,依据FeC2O4•nH2O计算得到n=2,生成一氧化碳物质的量为0.04mol,氧化亚铁物质的量为0.04mol,水的物质的量为0.08mol,结合氧化还原反应电子守恒计算得到二氧化碳物质的量为0.04mol,反应的化学方程式为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O
故答案为:FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$FeO+CO↑+CO2↑+2H2O.
点评 本题考查了物质性质的、实验基本操作的分析判断,主要是装置作用和实验基本操作,分解产物的实验验证和成分的分析判断,掌握方法和基础是关键,题目难度中等.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝钠合金的熔点比铝低 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 | |
| D. | m g不同组成的铝钠合金投入足量盐酸中,放出的H 2 越多,则铝的质量分数越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:Na2CO3>NaHCO3 | B. | 熔点:生铁>纯铁 | ||
| C. | 酸性:H2CO3>HClO | D. | 氧化性:Fe3+>Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25(b-2a)mol/L | B. | 4(2a-b)mol/L | C. | 2(b-2a)mol/L | D. | 4(b-2a)mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com