
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是 ( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
科目:高中化学 来源: 题型:
在一定条件下的反应N2(g)+ 3 H2(g)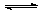 2NH3(g) △H<0达到平衡,下列变化既能加快反应速率又能使平衡向正反应方向移动的是
2NH3(g) △H<0达到平衡,下列变化既能加快反应速率又能使平衡向正反应方向移动的是
A.升温 B.减压 C.加压 D.加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2(g) N2O4 (g) △H < 0,若把烧瓶置于100℃ 的沸水中,下列情况中不变的是
N2O4 (g) △H < 0,若把烧瓶置于100℃ 的沸水中,下列情况中不变的是
A.气体的物质的量 B.压强 C.质量 D.密度
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产SO3的反应为:2SO2(g)+ O2(g) 2SO3(g) ,若在一定温度下,将0.1mol
2SO3(g) ,若在一定温度下,将0.1mol
的SO2(g)和0.06mol O2(g)注入一体积为2L的密闭容器中,10min达到平衡状态,此时测
得容器中有0.08mol的SO3(g)。试求在该温度下:
(1)SO2(g)的平衡转化率。 (2)此反应的平衡常数。 (要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与含氯化合物有关的说法正确的是( )
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4 LH2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1、-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为 5.52×103kJ 。
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(4)COCl2的分解反应为COCl2(g)===Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
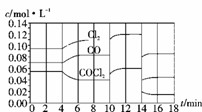
①计算反应在第8 min时的平衡常数K= 0.234 mol·L-1 ;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2) < T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= 0.031 mol·L-1;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小 v(2~3)>v(5~6)=v(12~13) ;
⑤比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小v(5~6) > v(12~13)(填“<”、“>”或“=”),原因是 在相同温度时,该反应的反应物浓度越高,反应速率越大 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中
D.SO2通入已酸化的Ba(NO3)2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷与氧可发生如下反应:P4+5O2===P4O10。
已知断裂下列化学键需要吸收的能量分别为:
P—P akJ·mol-1、P—O b kJ·mol-1、
P== O c kJ·mol-1、O==O d kJ·mol-1
根据下图所示的分子结构和有关数据
估算该反应的ΔH,其中正确的是
A.(6a+5d-4c-12b)kJ·mol-1 B.(4c+12b-6a-
5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4c+5d-4c-12b)kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com