
【题目】下表为4种常见溶液中溶质的质量分数和物质的量浓度:
溶质 | HCl | NaOH | CH3COOH | HNO3 |
溶质的质量分数/% | 36.5 | 40 | 60 | 63 |
物质的量浓度/mol·L1 | 11.8 | 14.3 | 10.6 | 13.8 |
这4种溶液中密度最小的是
A.HCl B.NaOH C.CH3COOH D.HNO3
科目:高中化学 来源: 题型:
【题目】相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是( )
A.C3H4和C2H6
B.C3H6和C3H8O2
C.C3H6O2和C3H8O
D.C3H8O和C4H6O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将赤铜矿(Cu2O)与辉铜矿(Cu2S)混合加热发生以下反应:Cu2S+2Cu2O ![]() 6Cu+SO2↑,下列说法错误的是( )
6Cu+SO2↑,下列说法错误的是( )
A.在Cu2O、Cu2S中Cu元素化合价都是+1价
B.反应中Cu元素被氧化,S元素被还原
C.Cu2S在反应中既是氧化剂,又是还原剂
D.每生成6.4g Cu,反应中转移0.1 mole﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图图示与对应的叙述相符的是( ) 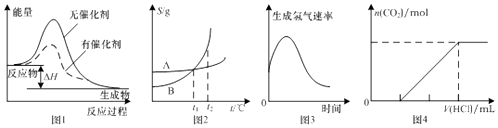
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示A,B两物质的溶解度随温度变化情况,将t1℃时A,B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应
D.图4表示在含等物质的量NaOH,Na2CO3的混合溶液中滴加0.1 molL﹣1盐酸至过量时,产生气体的体积与消耗盐酸的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在H2SO4、K2SO4、Al2(SO4)3和明矾[KAl(SO4)212H2O]的混合溶液中,H+的浓度为0.2mol/L,SO42﹣的浓度为0.5mol/L,当加入等体积0.6mol/L KOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+的浓度约为( )
A.0.225mol/L
B.0.25mol/L
C.0.45mol/L
D.0.55mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用.请按要求写出相应的方程式.
(1)将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO24﹣ , 其总反应为2SO2+O2+2H2O=2H2SO4 . 上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: .
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6﹣2x]溶液.若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因: .
(3)ClO2是一种高效安全的杀菌消毒剂.氯化钠电解法生产ClO2工艺原理示意图如下: 
①写出氯化钠电解槽内发生反应的离子方程式: .
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: .
③ClO2能将电镀废水中的CN﹣离子氧化成两种无毒气体,自身被还原成Cl﹣ . 写出该反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)由乙烯制取聚乙烯的化学方程: .
(2)写出下列物质的结构简式; ①2,3﹣二甲基戊烷
②3﹣甲基﹣2﹣戊烯
③间二甲苯
(3)分子中含有5个碳原子的链状单炔烃的分子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下面每一小题.
(1)除去乙烷中混有的少量乙烯,所用的试剂是;
(2)除去混在硝基苯中的硝酸,所用的试剂是;
(3)![]() 的一氯取代物有种
的一氯取代物有种
(4)2,3﹣二甲基﹣4﹣乙基已烷 (写出结构简式) .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com