
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的混合气体体积为(设反应中HNO3被还原成NO)( )
|
| A. | 0.448L | B. | 0.672L | C. | 0.896L | D. | 0.224L |
| 有关混合物反应的计算;硝酸的化学性质. | |
| 专题: | 计算题. |
| 分析: | 10mL混合酸中含有:n(H+)=0.01L×2×4mol/L+0.01L×2mol/L=0.1mol,n(NO3﹣)=0.01L×2mol/L=0.02mol,由于铁过量,则发生反应:3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,以此计算该题. |
| 解答: | 解:10mL混合酸中含有:n(H+)=0.01L×2×4mol/L+0.01L×2mol/L=0.1mol,n(NO3﹣)=0.01L×2mol/L=0.02mol, 由于铁过量,则发生反应:3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,则 3Fe+2NO3﹣+8H+=3Fe2++2NO↑+4H2O 0.02mol 0.08mol 0.02mol 反应后剩余n(H+)=0.1mol﹣0.08mol=0.02mol, Fe+2H+=Fe2++H2↑ 0.02mol 0.01mol 所以:n(NO)+n(H2)=0.02mol+0.01mol=0.03mol, V(NO)+V(H2)=0.03mol×22.4L/mol=0.672L, 故选B. |
| 点评: | 本题考查混合物的计算,题目难度中等,本题注意铁过量,根据n(H+)、n(NO3﹣)判断反应的可能性,判断生成气体为NO和H2的混合物,进而计算气体的体积,题目易错. |


科目:高中化学 来源: 题型:
下列推断正确的是
A.由H+(aq)+OH-(aq)=H20(1) △H=-57.3 kJ·mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ
B.由C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知石墨比金刚石更稳定
C.由N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ
D.由△G=△H-T△S可知,所有的放热反应都能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、NH4+、Cl﹣、SO42﹣、NO3﹣中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加人NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
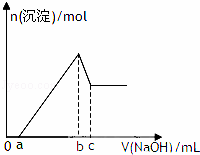
|
| A. | 一定没有Cu2+、NO3﹣、Cl﹣ | B. | 可能有K+、NH4+、NO3﹣、SO42﹣ |
|
| C. | 不能确定是否含有K+、NO3﹣ | D. | 一定有Mg2+、Al3+、Cl﹣、SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
)短周期元素A、B,C、D的原子序数依次增大,它们的核电荷数之和为32,最外层电子数之和为10;A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,则下列叙述正确的是( )
|
| A. | D处于元素周期表第3周期ⅥA族 |
|
| B. | 四种元素原子的半径大小顺序是A<B<C<D |
|
| C. | B、D的最高价氧化物具有相似的物理性质和化学性质 |
|
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸(H2C2O4)是二元中强酸,酸性KMnO4溶液能与草酸(H2C2O4)溶液反应.
Ⅰ、某探究小组利用该反应,用浓度为0.1000mol•L﹣1酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的离子方程式为 2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O .
(2)滴定过程中操作滴定管的图示正确的是 A .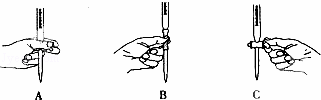
(3)本滴定达到终点的标志是: 当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点
(4)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度 偏高 ,
(填“偏高”、“偏低”、或“不变”).
Ⅱ、草酸氢钠溶液显酸性,常温下,向10mL 0.01mol/LNaHC2O4溶液中滴加0.01mol/LNaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是: BD
A、V(NaOH)=0时,c(H+)=1×10﹣2 mol/L
B、V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42﹣)+c(HC2O4﹣)
C、V(NaOH)=10mL时,c(H+)=1×10﹣7 mol/L
D、V(NaOH)>10mL时,c(Na+)>c(C2O42﹣)>c(HC2O4﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 化学键的断裂和形成是化学反应的实质,化学反应前后能量不变 |
|
| B. | 凡是放热反应都是自发的,吸热反应都是非自发的 |
|
| C. | 若一个反应的平衡常数越大,则表示该反应速率也越大 |
|
| D. | 升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与日常生活密切相关,下列说法正确的是( )
A. 碘酒只是指碘单质的乙醇溶液
B. 纯水不易导电,但属于电解质
C. 质量分数:医用酒精>生理盐水>食醋
D. 明矾可用于水的消毒、杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数,下列有关说法不正确的是( )
A.2.8g乙烯和丙烯的混合物中所含电子总数为1.6NA
B.0.1L 0.1mol/L的甲醛溶液和足量的碱性新制氢氧化铜悬浊液反应提供的电子数为0.02NA
C.0.1摩尔C10H22所含共价键的数目为3.1NA
D.1.7g羟基所含电子数为0.9 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com