
| A. | c(Fe3+)=c(Cl-) | B. | 3c(Fe3+)=c(Cl-) | C. | 3c(Fe3+)>c(Cl-) | D. | 3c(Fe3+)<c(Cl-) |
科目:高中化学 来源: 题型:解答题
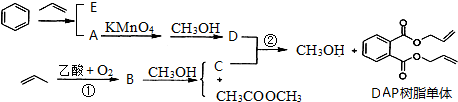

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 组别 | 甲 | 乙 | 丙 |
| A | SO2 | Ba(OH)2 | NaHCO3 |
| B | Na2O2 | H2O | CO2 |
| C | Na2SiO3 | NaOH | HCl |
| D | Al | H2SO4 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91.9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
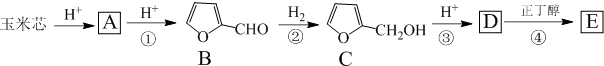
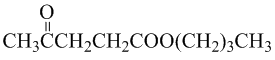 .
.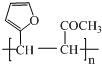 .写出反应的化学方程式
.写出反应的化学方程式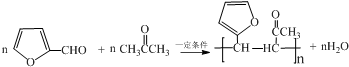 (不必注明反应条件).
(不必注明反应条件).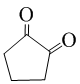 或
或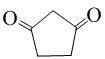 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池中镁为负极,发生还原反应 | |
| B. | 电池工作时,OH-向正极移动 | |
| C. | 该电池的总反应为:Mg+ClO-+H2O=Mg(OH)2↓+Cl- | |
| D. | 电池工作时,正极周围溶液的pH将不断变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 600mL 18.4mol/L H2SO4 | B. | 100mL 1mol/L HCl | ||
| C. | 200mL 80% HNO3 | D. | 600mL 0.1mol/L HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Cu2+、Fe3+、SO42- | B. | Na+、Ba2+、Al3+、Cl- | ||
| C. | K+、Ag+、NH4+、NO3- | D. | Na+、K+、Br-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化剂,又是还原剂 | |
| B. | NaNO2是氧化剂 | |
| C. | NH4Cl中的氮元素被还原 | |
| D. | 每生成1 mol N2时,转移电子的物质的量为6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com