
 CO2(g)+ H2(g) ЃЛЁїH<0ЁЃдк850ЁцЪБЃЌЦНКтГЃЪ§K=1ЁЃ
CO2(g)+ H2(g) ЃЛЁїH<0ЁЃдк850ЁцЪБЃЌЦНКтГЃЪ§K=1ЁЃ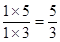 ЃО1ЃЌЫљвдЦНКтЯђФцЗДгІЗНЯђвЦЖЏЁЃ
ЃО1ЃЌЫљвдЦНКтЯђФцЗДгІЗНЯђвЦЖЏЁЃ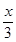 ЃМ1ЃЌМД 0ЁмxЃМ3 ЁЃ
ЃМ1ЃЌМД 0ЁмxЃМ3 ЁЃ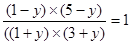 ЃЌНтЕУyЃН0.2molЃЌМДЦНКтЪБЧтЦјЪЧ4.8molЃЌЦфЬхЛ§ЗжЪ§ЮЊ
ЃЌНтЕУyЃН0.2molЃЌМДЦНКтЪБЧтЦјЪЧ4.8molЃЌЦфЬхЛ§ЗжЪ§ЮЊ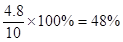 ЁЃЭЌбљШчЙћЕБxЃН6.0molЪБЃЌПЩМЦЫуГіЦНКтЪБЧтЦјЪЧ52.1ЃЅЃЌЫљвдaаЁгкbЁЃ
ЁЃЭЌбљШчЙћЕБxЃН6.0molЪБЃЌПЩМЦЫуГіЦНКтЪБЧтЦјЪЧ52.1ЃЅЃЌЫљвдaаЁгкbЁЃ


| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 ?pC(g)ЃЋqD(g)(ШчЭМ)БэЪОЕФЪЧзЊЛЏТЪгыбЙЧПЁЂЮТЖШЕФЙиЯЕЁЃЗжЮіЭМжаЧњЯпПЩвдЕУГіЕФНсТлЪЧ(ЁЁЁЁ)
?pC(g)ЃЋqD(g)(ШчЭМ)БэЪОЕФЪЧзЊЛЏТЪгыбЙЧПЁЂЮТЖШЕФЙиЯЕЁЃЗжЮіЭМжаЧњЯпПЩвдЕУГіЕФНсТлЪЧ(ЁЁЁЁ)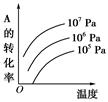
| AЃЎе§ЗДгІЮќШШЃКmЃЋn>pЃЋq |
| BЃЎе§ЗДгІЮќШШЃКmЃЋn<pЃЋq |
| CЃЎе§ЗДгІЗХШШЃКmЃЋn>pЃЋq |
| DЃЎе§ЗДгІЗХШШЃКmЃЋn<pЃЋq |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 2Z(g)ЃЌО12sДяЕНЦНКтЃЌЩњГЩ0.6molZЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
2Z(g)ЃЌО12sДяЕНЦНКтЃЌЩњГЩ0.6molZЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ| AЃЎвдXХЈЖШБфЛЏБэЪОЕФЗДгІЫйТЪЮЊ1/8mol/(LЁЄS) |
| BЃЎ12sКѓНЋШнЦїЬхЛ§РЉДѓЮЊ10LЃЌZЕФЦНКтХЈЖШБфЮЊдРДЕФ1/5 |
| CЃЎШєдіДѓXЕФХЈЖШЃЌдђЮяжЪYЕФзЊЛЏТЪМѕаЁ |
| DЃЎШєИУЗДгІЕФЁїHЃМ0 ЃЌЩ§ИпЮТЖШЃЌЦНКтГЃЪ§KМѕаЁ |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 COЃЈgЃЉ+H2ЃЈgЃЉ ЁїH=+131.3KJ.mol-1[ИїШнЦїжаC(s)ОљзуСП]ЃЌдкФГЪБПЬВтЕУгаЙиЮяжЪЕФХЈЖШМАе§ЁЂФцЗДгІЫйТЪЕФЙиЯЕШчЯТБэЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
COЃЈgЃЉ+H2ЃЈgЃЉ ЁїH=+131.3KJ.mol-1[ИїШнЦїжаC(s)ОљзуСП]ЃЌдкФГЪБПЬВтЕУгаЙиЮяжЪЕФХЈЖШМАе§ЁЂФцЗДгІЫйТЪЕФЙиЯЕШчЯТБэЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ 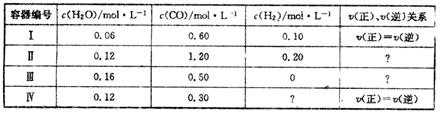
| AЃЎдкШнЦїЂђжаЃЌv(е§)ЃМv(Фц) |
| BЃЎдкШнЦїЂєжаЃЌH2ЕФХЈЖШЮЊ0.40 mol.L-1 |
| CЃЎдкШнЦїЂѓжа, ЗДгІДяЕНЦНКтЪБЮќЪеЕФШШСПЮЊ13.13 KJ |
| DЃЎШєНЋЦНКтЪБШнЦїЂёЁЂЂєжаЕФЮяжЪЛьКЯгкШнЛ§ЮЊ1LЕФШнЦїжа,дђЗДгІШдДІгкЦНКтзДЬЌ |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
AЃЎFe2O3(s)ЃЋ3CO(g) 2Fe(s)ЃЋ3CO2(g) 2Fe(s)ЃЋ3CO2(g) | BЃЎ3H2(g)ЃЋN2(g) 2NH3(g) 2NH3(g) |
CЃЎ2SO2(g)ЃЋO2(g) 2SO3(g) 2SO3(g) | DЃЎC(s)ЃЋCO2(g) 2CO(g) 2CO(g) |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 CO + H2OЃЌвбжЊДяЦНКтЪБЩњГЩ0.75 mol COЃЌдђЕБH2 ИФЮЊ9 mol ЪБЃЌдкЩЯЪіЬѕМўЯТжиаТДяЦНКтЪБЃЌЩњГЩCOКЭЫЎеєЦјЮяжЪЕФСПжЎКЭПЩФмЮЊЃЈ ЃЉ
CO + H2OЃЌвбжЊДяЦНКтЪБЩњГЩ0.75 mol COЃЌдђЕБH2 ИФЮЊ9 mol ЪБЃЌдкЩЯЪіЬѕМўЯТжиаТДяЦНКтЪБЃЌЩњГЩCOКЭЫЎеєЦјЮяжЪЕФСПжЎКЭПЩФмЮЊЃЈ ЃЉ| AЃЎ2.0mol | BЃЎ1.5mol | CЃЎ1.8mol | DЃЎ2.5mol |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЕЅбЁЬт
 2Z(g) ЃЌДЫЗДгІДяЕНЦНКтЕФБъжОЪЧЃЈ ЃЉ
2Z(g) ЃЌДЫЗДгІДяЕНЦНКтЕФБъжОЪЧЃЈ ЃЉ| AЃЎШнЦїФкбЙЧПВЛЫцЪБМфБфЛЏ |
| BЃЎvе§(X)=vФц(Z) |
| CЃЎШнЦїФкXЁЂYЁЂZЕФХЈЖШжЎБШЮЊl:2 :2 |
| DЃЎЕЅЮЛЪБМфЯћКФ0.1 mol XЭЌЪБЩњГЩ0.2 mol Z |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЬюПеЬт
 2NH3ЃЈgЃЉЁїH
2NH3ЃЈgЃЉЁїH| AЃЎ3v(H2)е§=2v(NH3)Фц |
| BЃЎЕЅЮЛЪБМфФкЩњГЩn mol N2ЕФЭЌЪБЩњГЩ2n molNH3 |
| CЃЎЛьКЯЦјЬхЕФУмЖШВЛдйИФБф |
| DЃЎШнЦїФкбЙЧПВЛЫцЪБМфЕФБфЛЏЖјБфЛЏ |
| ЪЕбщБрКХ | T(Ёц) | n (N2)/n(H2) | P(MPa) | ЦНКтЪБNH3АйЗжКЌСП |
| ЂЁ | 450 | 1/3 | 1 | |
| ЂЂ | Ђй | 1/3 | Ђк | |
| ЂЃ | 480 | 1/3 | 10 | |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃКВЛЯъ ЬтаЭЃКЬюПеЬт
| 25ЁцЦНКтЬхЯЕЃЈБНЁЂЫЎЁЂHAЃЉ | ЦНКтГЃЪ§ | ьЪБф | Ц№ЪМзмХЈЖШ |
| дкЫЎжаЃЌHA === HЃЋЃЋAЃ | K1 | ЁїH1 | 3.0ЁС10Ѓ3 molЁЄLЃ1 |
| дкБНжаЃЌ2HA == (HA)2 | K2 | ЁїH2 | 4.0ЁС10Ѓ3 molЁЄLЃ1 |
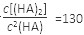 ЃЌдђЗДгІЯђ_______ЗНЯђНјааЁЃ
ЃЌдђЗДгІЯђ_______ЗНЯђНјааЁЃ (HA)2ЃЌвбжЊИУЖўОлЗДгІЕФЗДгІШШЪ§жЕдМЮЊЛюЛЏФмЕФ5/9 ЁЃЯТСаФмСПЙиЯЕЭМзюКЯРэЕФЪЧ ЁЃ
(HA)2ЃЌвбжЊИУЖўОлЗДгІЕФЗДгІШШЪ§жЕдМЮЊЛюЛЏФмЕФ5/9 ЁЃЯТСаФмСПЙиЯЕЭМзюКЯРэЕФЪЧ ЁЃ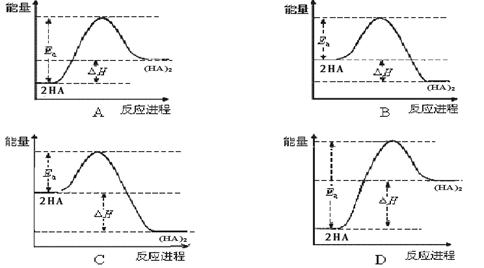
 ЃЈHAЃЉ2ЕФЦНКтГЃЪ§K2ОљБфДѓЁЃ
ЃЈHAЃЉ2ЕФЦНКтГЃЪ§K2ОљБфДѓЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com