


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
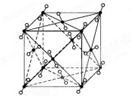 (1)如图为干冰的晶胞结构,观察图形,确定在干冰中每个CO2分子周围有
(1)如图为干冰的晶胞结构,观察图形,确定在干冰中每个CO2分子周围有查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 1、向试管中加锌粒 | 2、对量筒中液体读数 | 3、稀释浓H2SO4 |
| 错误操作 | 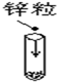 | 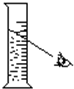 | 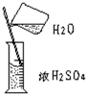 |
| 不良后果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Na2CO3溶液中滴入酚酞试液,溶液变红CO32-+2H2O?H2CO3+2OH- |
| B、向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgC1+S2-=Ag2S↓+2C1- |
| C、铜器在潮湿的环境中表面生成一层“铜绿”:Cu+O2+CO2=CuCO3 |
| D、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com