
分析 (1)铝热剂是金属铝和氧化铁的混合物,金属铝可以和氢氧化钠之间反应生成偏铝酸钠和氢气;
(2)金属铁可以和盐酸反应生成氯化亚铁和氢气,根据金属的量之比确定氢气的量之比.
解答 解:(1)铝热剂是金属铝和氧化铁的混合物,金属铝可以和氢氧化钠之间反应生成偏铝酸钠和氢气,即2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,根据方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,当生成的氢气(标准状况,下同)体积为bL时,则样品中Al的质量为:$\frac{b}{22.4}×\frac{2}{3}$momol×27g/mol=$\frac{45b}{56}$g,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)根据反应:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,铝的物质的量是$\frac{b}{22.4}×\frac{2}{3}$mol=$\frac{b}{33.6}$mol,产生铁的物质的量是$\frac{b}{33.6}$mol,这些铁产生氢气的物质的量是$\frac{b}{33.6}$mol,即c=$\frac{b}{33.6}$mol×22.4L/mol=$\frac{2b}{3}$,所以c:b=2:3,铁的质量为:$\frac{b}{33.6}$×56g,所以Al的质量分数为$\frac{\frac{45b}{56}}{\frac{56b}{33.6}+\frac{45b}{56}}×100%$=32.4%,
故答案为:2:3;32.4%.
点评 本题考查学生铝热反应的有关知识,注意金属铝可以和氢氧化钠反应生成氢气这一性质,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NO、O2、NO2分子数目比是2:1:2 | |
| B. | 反应混合物中各组分物质的浓度相等 | |
| C. | 混合气体的总质量不变 | |
| D. | 混合气体的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiC俗称金刚砂,可用作砂纸、砂轮的磨料 | |
| B. | 金属铝熔点高,所以我们可以用铝制器皿煮饭 | |
| C. | 硅酸钠俗称水玻璃,可用作黏合剂和木材防火剂 | |
| D. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
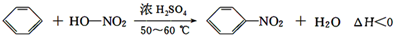
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
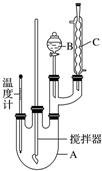
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H2CO3+OH- | B. | HS-+H2O?S2-+H3O- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | H3PO4?3H++PO43+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
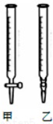 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 21.30 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
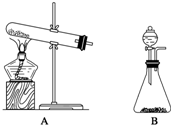 氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:
氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com