
 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | A | B | C | 30 | t2 |
| ③ | 常温 | 2 | 40 | D | E | t3 |
分析 (1)根据该实验探究不同的初始pH和草酸溶液浓度对反应速率的影响,所以KMnO4的浓度不变,探究外界条件对反应速率的影响,需保证其他条件相同时来实验;
(2)草酸与高锰酸钾反应是锰离子和二氧化碳、水;
(3)实验①和②只有pH不同,其它条件都相同;
(4)根据外界条件对化学反应速率的影响;
(5)草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点;
根据称量固体用天平、配制溶液用容量瓶、量取液体用滴定管分析;
先求出醋酸的浓度,再由关系式2KMnO4~5H2C2O4计算.
解答 解:(1)根据该实验探究不同的初始pH和草酸溶液浓度对反应速率的影响,实验要求控制KMnO4溶液初始浓度相同,则KMnO4溶液的体积为50mL,总体积为100mL,则C=50,D=50,B=20,E=10,探究外界条件对反应速率的影响,需保证其他条件相同,则①与②的pH不同,②与③的草酸浓度不同,
则A=2,
故答案为:2;50;10;
(2)草酸与高锰酸钾反应是锰离子和二氧化碳、水,其反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
故答案为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;
(3)实验①和②只有pH不同,其它条件都相同,而且t1<t2,说明其他条件相同时,溶液的初始pH越小,该反应的反应速率越快;
故答案为:其他条件相同时,溶液的初始pH越小,该反应的反应速率越快;
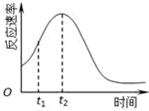
(4)对于该反应,影响化学反应的速率只有温度和催化剂,所以反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:反应放热,温度升高或产物Mn2+是反应的催化剂;
故答案为:该反应放热;产物Mn2+是反应的催化剂;
(5)高锰酸钾本身有颜色,故不需要另加指示剂,草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点;
称量固体用托盘天平、配制250ml溶液用250mL容量瓶、量取KMnO4溶液和草酸溶液用到酸式滴定管;
c(草酸)=$\frac{\frac{ag}{126g/mol}}{0.25L}$=$\frac{4a}{126}$mol/L
由关系式 2KMnO4 ~5H2C2O4
2 5
cmol•L-1×V×10-3L $\frac{4a}{126}$mol/L×25×10-3mol
c=$\frac{\frac{4a}{126}×25×1{0}^{-3}×\frac{2}{5}}{V×1{0}^{-3}}$mol/L=$\frac{20a}{63V}$mol/L,
故答案为:加入最后一滴KMnO4溶液,溶液变为红色,且30s内红色不褪去;托盘天平、250mL容量瓶、(酸式)滴定管;$\frac{20a}{63V}$;
点评 本题主要结合实验考查了影响化学反应速率的因素,题目难度中等,注意温度、浓度、催化剂对化学反应速率的影响,在探究外界条件对反应速率的影响时,必须保证其他影响反应速率的条件一致.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑤ | C. | ①③ | D. | ②④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br的沸点比CH3CH3的沸点高 | |
| B. | 所有卤代烃都能够发生水解反应和消去反应 | |
| C. | 溴乙烷与Na0H水溶液共热生成乙烯 | |
| D. | 在溴乙烷中加入AgN03溶液,立即产生淡黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
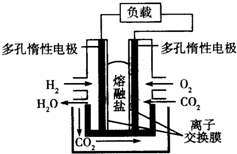
| A. | CO2在电池反应过程中不参与反应 | |
| B. | 电池总反应为2H2O═O2↑+2H2↑ | |
| C. | 该离子交换膜为阳离子交换膜 | |
| D. | 电池正极反应式为O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol KClO3参加反应,转移2mol电子 | |
| B. | KClO3在反应中被还原 | |
| C. | H2C2O4的还原性强于ClO2 | |
| D. | CO2是H2C2O4被氧化后得到的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,同周期从左到右原子半径从小到大(稀有气体除外)发生周期性变化 | |
| C. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| D. | 元素原子核外电子排布的周期性变化是导致原子半径、元素主要化合价和元素性质周期性变化的主要原因 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com