
| A. | 用氨水吸收过量的二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | |
| C. | 双氧水作脱氧剂,用于消除水中的氯气:Cl2+H2O2═2H++O2+2Cl- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++SO42-+4OH-═AlO2-+2BaSO4↓+2H2O |
分析 A.氨水与过量的二氧化硫反应生成亚硫酸氢铵;
B.酸性条件下,过氧化氢与碘离子反应生成单质碘和水;
C.氯气与双氧水反应生成HCl和氧气;
D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明SO42-与Ba2+的比例是1:2,生成一水合氨和氢氧化铝.
解答 解:A.氨水与过量的二氧化硫反应生成亚硫酸氢铵,反应的离子方程式为:NH3•H2O+SO2═NH4++HSO3-,故A正确;
B.酸性条件下,过氧化氢与碘离子反应生成单质碘和水,反应的离子方程式为:2I-+H2O2+2H+═I2+2H2O,故B正确;
C.氯气与双氧水反应生成HCl和氧气,反应的离子方程式为:Cl2+H2O2═2H++O2+2Cl-,故C正确;
D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,生成一水合氨和氢氧化铝,离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故D错误.
故选D.
点评 本题考查了离子方程式的书写,题目难度中等,涉及氧化还原反应、复分解反应,明确反应实质是解题关键,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与醋酸反应:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | NaHCO3溶液显碱性:HCO3-+H2O═CO32-+H3O+ | |
| D. | 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
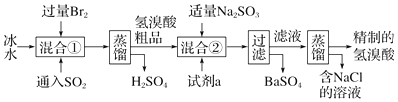
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验H的 | 实验方案 |
| A | 证明Mg(OH)2沉淀可以转化为 Fe(OH)3 | 向2mL1mol/LNaOH溶液中先加入3滴1mol/LMgCl2溶液,再加入3滴1mol/LFeCl3溶液 |
| B | 比较氯和碳的非属性强弱 | 将盐酸滴入碳酸氢钠溶液中 |
| C | 验证电解饱和食盐水阳极有氯气生成 | 以铁为电极电解饱和食盐水,并将阳极生成的气体通入淀粉-KI溶液 |
| D | 比较铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3 | |
| B. | 乙醇溶液和双氧水均可用于杀菌消毒,其原理相同 | |
| C. | 用玻璃棒蘸取酸性高锰酸钾溶液,滴在pH试纸上,然后与标准比色卡对照,测其pH | |
| D. | “一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称,丝绸的主要成分是天然纤维素,属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| B | 向1mL 1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡,再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | 说明Y中不含醛基 |
| C | 取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(已转化为标准状况下) | 测定铝箔中氧化铝的含量 |
| D | 比较不同反应的反应热数据大小 | 从而判断反应速率的大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用植物油的氧化反应可获得人造脂肪 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 工业生产玻璃、水泥和陶瓷,均需用石灰石作原料 | |
| D. | 明矾和“84”消毒液均可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,0.4mol•L-1一元酸HA与0.2mol•L-1NaOH溶液等体积混合后,所得溶液pH>7,溶液部分微粒组分及浓度如图所示.下列说法正确的( )
常温下,0.4mol•L-1一元酸HA与0.2mol•L-1NaOH溶液等体积混合后,所得溶液pH>7,溶液部分微粒组分及浓度如图所示.下列说法正确的( )| A. | HA是弱酸 | |
| B. | 图中未表示出的微粒的浓度小于0.1mol/L | |
| C. | 该混合溶液中:c(HA)+c(X)═c(Na+) | |
| D. | 图中M表示HA,Y表示OH-,Z表示H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com