
(16分)氨气是一种重要的化工产品及工业原料。
I.某温度下,合成氨反应的平衡常数K=3.0×103(mol/L)-1,
(1)写出其对应的化学方程式____________________________________________________ 。
(2)某温度下,如果在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则反应_______(填“正向进行”或“逆向进行”或“达到平衡”)。
(3)该温度下,在体积恒定为10L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是___________________。
a.10molN2、30molH2和20molNH3 b.10molN2和30molH2
c.20molN2和60molH2 d.10molN2和28molH2
II.氨气极易溶于水,氨水是氨气溶于水而形成的溶液,回答下列问题:
(4)在氨水溶液中加水稀释的过程,NH3·H2O的电离程度___________(填“增大”“减小”或“不变”), ___________(同上)。
___________(同上)。
(5)室温下,a mol/L的(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡________________________(用离子方程式表示)。并计算该平衡的平衡常数表达式为________________________(用含代数a的较为精确的数学表达式表示,不必化简,不做近似运算)。
(6)室温下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为_________________________________________。
(已知:室温时 mol3
mol3 mol3.L-3).
mol3.L-3).
Ⅰ. (1)1/2 N2 + 3/2 H2 NH3(2分) (2)正向进行(2分) (3)c(2分)
NH3(2分) (2)正向进行(2分) (3)c(2分)
Ⅱ.(4)增大(1分) 不变 (2分)
(5)NH4++H2O NH3?H2O+H+ (2分) 10-5(10-5-10-9)/2a+10-9-10-5 mol·L-1(2分)
NH3?H2O+H+ (2分) 10-5(10-5-10-9)/2a+10-9-10-5 mol·L-1(2分)
(6)Cu(OH)2(1分) Cu2++2NH3·H2O=Cu(OH)2 ↓+2NH4+(2分)
【解析】
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据平衡常数可知反应的化学方程式为1/2 N2 + 3/2 H2 NH3。
NH3。
(2)在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则产生浓度熵为 =2000<3000,所以反应向正反应方向进行。
=2000<3000,所以反应向正反应方向进行。
(3)a与b相比,a中含有大量的氨气,因此b中氨气的转化率大于a中。b与d相比,b中氢气浓度大,大转化率高;由于正方应是体积减小的可逆反应,所以增大压强平衡向正反应方向进行,c与b相比,相当于是在b的基础上增大压强,氮气转化率增大,答案选c。
(4)稀释促进氨水的电离,电离程度增大。 ,因此比值不变。
,因此比值不变。
(5)铵根水解溶液显酸性,方程式为NH4++H2O NH3?H2O+H+。室温下,在a mol?L-1的(NH4)2SO4水溶液中pH=5,溶液中c(H+)=10-5mol/L,故溶液中c(OH-)=10-9mol/L,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol/L=10-9mol/L+2amol/L,则c(NH4+)=(2a+10-9-10-5)mol/L,根据物料守恒计算溶液中c(NH3?H2O)=2amol/L-(2a+10-9-10-5)mol/L=(10-5-10-9)mol/L,故NH4++H2O
NH3?H2O+H+。室温下,在a mol?L-1的(NH4)2SO4水溶液中pH=5,溶液中c(H+)=10-5mol/L,故溶液中c(OH-)=10-9mol/L,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol/L=10-9mol/L+2amol/L,则c(NH4+)=(2a+10-9-10-5)mol/L,根据物料守恒计算溶液中c(NH3?H2O)=2amol/L-(2a+10-9-10-5)mol/L=(10-5-10-9)mol/L,故NH4++H2O NH3?H2O+H+的平衡常数的表达式为
NH3?H2O+H+的平衡常数的表达式为 。
。
(6)溶度积常数越小的物质越先沉淀,氢氧化铜的溶度积小于氢氧化镁的溶度积,所以氢氧化铜先沉淀,铜离子和氨水反应生成氢氧化铜沉淀和铵根离子,离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+。
考点:考查平衡常数计算与应用、外界条件对电离平衡的影响、盐类水解以及溶度积常数应用等


科目:高中化学 来源:2016届河南省高一上学期第一次月考化学试卷(解析版) 题型:选择题
中国食盐产量居世界首位。下列实验室中的操作类似“海水煮盐”原理的 ( )
A.蒸馏 B.蒸发 C.过滤 D.搅拌
查看答案和解析>>
科目:高中化学 来源:2016届安徽省铜陵市高一下学期期末考试化学试卷(解析版) 题型:选择题
X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是
A.原子序数X<Y B.离子半径X<Y
C.原子半径X<Y D.原子最外层电子数X>Y
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古高一下学期期末考试化学试卷(解析版) 题型:选择题
下列变化中,属于化学变化的是
A.用苯从溴水中萃取溴 B.重油裂化得到轻质燃料油
C.碘的升华 D.石油分馏得到汽油、煤油等产物
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古高一下学期期末考试化学试卷(解析版) 题型:选择题
下列各组中化合物的性质比较,不正确的是
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.非金属性:F>O>S
D.稳定性:PH3>H2S>HCl
查看答案和解析>>
科目:高中化学 来源:2015界山东省高三第一次9月诊断性考试化学试卷(解析版) 题型:选择题
常温下,浓度均为0.1 mol/L的6种盐溶液pH如下:

下列说法正确的是
A. Cl2和Na2CO3按物质的量之比1:1反应的化学方程式为Cl2+Na2CO3+H2O=HClO+NaHCO3+NaCl
B.相同条件下电离程度比较:HCO3->HSO3->HClO
C.6种溶液中,Na2SiO3溶液中水的电离程度最小
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2015界山东省高三第一次9月诊断性考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.硅酸钠溶液与醋酸溶液混合: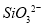 +
+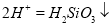
C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:
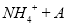 1
1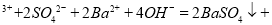 A1
A1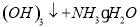
D.向次氯酸钙溶液通入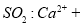
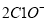 +
+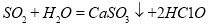
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省高三第一次模拟考试化学试卷(解析版) 题型:填空题
(6分)
某无色透明溶液可能存在Na+、Fe3+、Ba2+、NO3-、CO32-、HCO3-、SO42-中的几种离子,现有如下操作:
Ⅰ、取适量该溶液加入CaCl2溶液无沉淀,继续滴加盐酸产生无色无味的气体。
Ⅱ、另取该溶液滴加一定量的NaOH溶液有白色沉淀生成。
试回答下列问题:
该溶液中一定存在的离子有______________,一定不存在的离子_____________。
用一个离子方程式表示操作②的实验现象:
________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届黑龙江省绥化市三校高三上学期期中联考化学试卷(解析版) 题型:选择题
在下列条件下,能大量共存的微粒组是
A.c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32-
B.右表提供的数据下:HClO 、HCO3-、ClO-、CO32-
C.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I-
D.中性的溶液中:CO32-、Na+、SO42-、AlO2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com