
【题目】过碳酸钠(2Na2CO3·3H2O2)广泛用于洗涤、纺织、医疗、造纸等。某兴趣小组展开了深入的学习:
【资料卡片】:

I、制备研究:工业上采用“醇析法”将其转化成固态的过碳酸钠晶体(化学式为2Na2CO3·3H2O2), “醇析法”的生产工艺流程如下:
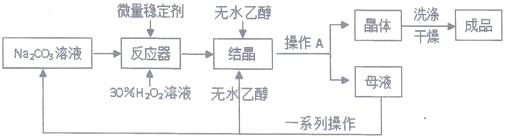
请回答问题:
(1)Na2CO3俗名:_______________;其水溶液能使酚酞变_______________;
(2)H2O2受热容易分解,写出该分解反应的方程式:_________________;
(3)生产过程中,反应及干燥均需在低温度下进行,原因是________________;
(4)生产过程中,加入较多无水乙醇后,过碳酸钠晶体大量析出,此无水乙醇的作用可能是_________________;
(5)操作A的名称是______________,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒和_____________;
(6)母液可以循环使用,但须进行“一系列操作”分离,这些操作包括:加入少量___________,不再有气泡产生后,过滤,将所得滤液再进行______________(填操作名称),即可得Na2CO3溶液和95%的乙醇。为获取无水乙醇,还需进行的操作是:向95%的乙醇中加入足量CaO后,选__________(填序号)装置进行实验。
II、纯度测定:兴趣小组同学设计了如图1所示实验装置(部分仪器略去),测定过碳酸钠样品中2Na2CO3·3H2O2的质量分数。步骤如下:
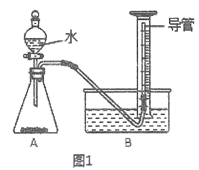
① 连接仪器并检查好气密性
② 将过碳酸钠样品(2.20g)和少许MnO2均匀混合后置于装置A中,在量筒中加满水;
③ 连接仪器,打开滴液漏斗活塞,缓缓滴入水;
④ 待装置A中_____________时,停止滴加水,并关闭活塞;
⑤ 冷却至室温后,平视读数;
⑥ 根据数据进行计算。
请回答下列问题:
(7)完善实验步骤的相关内容:④ __________;
(8)第⑤中,已“冷却至室温”的判断依据是:_____________;
(9)量筒中,加装的长导管的作用是:______________;
(10)实验中,______________,则开始收集气体;
A.刚开始出现气泡时
B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
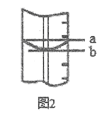
(11)量筒的局部示意见图2,平视读数时应沿____________视线(选填“a”或“b”) 进行。图中________视线(选填“a”或“b”)对应的读数较大。
(12)若量筒中收集到气体的体积是224mL (己转化为标准状况下的数据),计算过碳酸钠样品中2Na2CO3·3H2O2的质量分数:_____________;[Mr(O2)=32、Mr(2Na2CO3·3H2O2)=314]
(13)经过讨论,小组同学一致认为测定结果偏大,理由是_________________(任写一种)。
【答案】
I、(1)纯碱;红;
(2)2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)H2O2和2Na2CO3·3H2O2受热都容易分解;
(4)无水乙醇能降低过碳酸钠溶解度;
(5)过滤;漏斗;
(6)MnO2;蒸馏;A;
II、(7)无气泡冒出(或无明显现象);
(8)量筒内液面不再变化;
(9)防止冷却时,(短导管)将量筒中的水倒吸入A中影响测量;
(10)A;
(11)b;b;
(12)95%或95.1%;
(13)①滴液漏斗中的水进入A中,挤出一部分气体入量筒中
②量筒中导气管占有部分空间
③当量筒中的液面高于水槽中的时,量筒内部气压小于外界大气压,使测量的气体体积偏大。
【解析】
试题分析:I、(1)Na2CO3俗名是纯碱;其水溶液水解显碱性,能使酚酞变红色,故答案为:纯碱;红;
(2)H2O2受热容易分解,分解反应的方程式为2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)过氧化氢和过碳酸钠在加热时均会分解,因此生产过程中,反应及干燥均需在低温度下进行,故答案为:H2O2和2Na2CO3·3H2O2受热都容易分解;
(4)生产过程中,加入较多无水乙醇后,无水乙醇能降低过碳酸钠溶解度,使得过碳酸钠晶体大量析出,故答案为:无水乙醇能降低过碳酸钠溶解度;
(5)分离出过碳酸钠晶体,可以用过滤的方法进行,过滤存在需要的玻璃仪器有烧杯、玻璃棒和漏斗,故答案为:过滤;漏斗;
(6)母液中是饱和过碳酸钠溶液,其中的过碳酸钠可以循环使用,要得到Na2CO3溶液和95%的乙醇,需要首先使过氧化氢分解,可以加入二氧化锰作催化剂,分离Na2CO3溶液和乙醇,可以利用乙醇易挥发的性质选用蒸馏进行分离,为获取无水乙醇,还需进行的操作是:向95%的乙醇中加入足量CaO后蒸馏,故选装置A,故答案为:MnO2;蒸馏;A;
II、(7)根据实验操作过程,④待装置A中不再产生气泡时,停止加水,并关闭活塞,故答案为:无气泡冒出;
(8)第⑤中,当量筒内液面不再变化,表明已“冷却至室温” ,故答案为:量筒内液面不再变化;
(9)量筒中,加装的长导管可以防止冷却时,(短导管)将量筒中的水倒吸入A中影响测量,故答案为:防止冷却时,(短导管)将量筒中的水倒吸入A中影响测量;
(10)开始锥形瓶中有空气,最后锥形瓶中留有制取的氧气,两者体积相同,所以一开始就应当收集,故选A;
(11)量筒的局部示意见图2,平视读数时使溶液的凹液面与刻度相切,故选b;量筒的刻度是从下向上标注的,该量筒倒置,因此图中b对应的读数较大,故答案为:b;b;
(12)过碳酸钠分解产生氧气质量为224mL×10-3×1.43gL-1=0.32g
2(2Na2CO33H2O2)~3O2↑
628 96
x 0.32g
![]() =
=![]() ,解得:x=2.09g,则样品中,2Na2CO33H2O2的质量分数为:
,解得:x=2.09g,则样品中,2Na2CO33H2O2的质量分数为:![]() ×100%=95.0%,故答案为:95%;
×100%=95.0%,故答案为:95%;
(13)滴入的水占据了锥形瓶内的体积,或者量筒中导气管占有部分空间,或者当量筒中的液面高于水槽中的时,量筒内部气压小于外界大气压,都会使测量的气体体积偏大,导致测定结果偏大,故答案为:滴入的水占据了锥形瓶内的体积,使得O2体积偏大(或者量筒中导气管占有部分空间、当量筒中的液面高于水槽中的时,量筒内部气压小于外界大气压,)


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g)△H<0
2SO3(g)△H<0
(1)如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为 .
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图1所示.根据图示回答下列问题:

该反应的平衡常数的表达式为 平衡状态由A变到B时平衡常数K(A) K(B)(填“>”、“<”或“=”).
(2)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是 (填字母).
A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、SO3的物质的量之比为2:1:2
D.接触室中压强不随时间变化而变化
(4)图2表示该反应在密闭容器中达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~ b过程中改变的条件可能是 ;b~c过程中改变的条件可能是 ; 若增大压强时,请把反应速率变化情况画在c~d处.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是(已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(AgBr)=7.7×10-13)( )
A. AgCl>AgI>AgBr B. AgCl>AgBr>AgI
C. AgBr>AgCl>AgI D. AgBr>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是 ( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是 ( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v正减小
③压强增大一倍,平衡不移动,v正、v逆不变
④增大B的浓度,v正>v逆
⑤加入催化剂,平衡向正反应方向移动
A.①② B.④ C.③ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列反应在任何温度下均能自发进行的是( )
A.2N2(g)+O2(g)===2N2O(g)ΔH=+163 kJ·mol-1
B.Ag(s)+![]() Cl2(g)===AgCl(s)ΔH=-127 kJ·mol-1
Cl2(g)===AgCl(s)ΔH=-127 kJ·mol-1
C.HgO(s)===Hg(l)+![]() O2(g) ΔH=+91 kJ·mol-1
O2(g) ΔH=+91 kJ·mol-1
D.H2O2(l)=== ![]() O2(g)+H2O(l) ΔH=-98 kJ·mol-1
O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究过氧化氢的性质。回答下列问题:
(1)甲组同学拟配制5%的H2O2溶液,他们先从文献查得H2O2的稳定性与pH的关系如图所示。则配制H2O2溶液时应滴入几滴_____________(填“稀硫酸”或“氨水”)。

(2)乙组同学向一支试管中加入2mLFeCl2溶液,再滴入几滴甲组同学配制的H2O2溶液,最后滴人KSCN溶液,溶液变红,H2O2与Fe2+发生反应的离子方程式为_________________;另取一支试管,向其中加入SO2与BaCl2混合溶液2mL,再滴入几滴5%的H2O2溶液,现象是_____________。
(3)丙组同学取2mLKMnO4溶液于试管中,向其中滴几滴5%的H2O2溶液,发现溶液逐渐褪色,该反应中的还原剂是____________(填化学式)。
(4)丁组同学向一支试管中加入2mL5%的H2O2溶液、0.5mL乙醚、1mLlmol/LH2SO4溶液和3~4滴0.5mol/LK2Cr2O7溶液,发现上层乙醚层为蓝色(CrO5的乙醚溶液),一段时间后上层蓝色消失。

①乙醚的主要作用是____________。
②开始时,H2O2溶液与K2Cr2O7酸性溶液反应生成CrO5,该反应属于____________(填“氧化还原”或“非氧化还原”)反应。
③一段时间后,乙醚层中的CrO5与水相中的H+作用生成Cr3+并产生无色气泡,从而使蓝色逐渐消失,该反应的离子方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com