
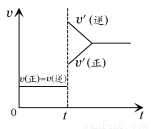
向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g) ΔH<0,当达到平衡后,t1时刻改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是 ( )
2HI(g) ΔH<0,当达到平衡后,t1时刻改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是 ( )
A.容器内气体的颜色变深,混合气体的密度增大
B.平衡不发生移动
C.I2(g)转化率增大,HI平衡浓度变小
D.改变条件前后,速率图像如图所示
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
已知AgI为黄色沉淀,AgCl为白色沉淀。25°C时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是 ( )
A.溶液中所含溶质的离子浓度大小关系为: c(K+)>c(NO3—)>c(Cl-)>c(I-)>c(Ag+)
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:填空题
强酸制弱酸是复分解反应的一条重要规律。这里的“强酸”、“弱酸”指相对强弱,能呈现酸性的一些非酸类物质,如酚类、两性氢氧化物、酸式盐等参与的反应也可根据其酸性强弱运用上述规律来判断其产物。
(1)HA、H2B是两种弱酸,有如下关系:H2B(少量)+2A-=B2-+2HA,则A-、HB-、B2-三种离子中,最易结合质子(H+)的是________。
(2)酸性强弱除与物质的本性有关外,还与溶剂有关,如CH3COOH与HF在液氨中受NH3影响可发生完全电离。在液氨中CH3COONa+HCl―→NaCl+CH3COOH这一反应能否发生________(填“能”或“否”),理由是____________________。
(3)某同学实验发现,将H2S气体通入CuSO4溶液中,生成黑色沉淀。弄清沉淀是CuS后,写出了化学方程式:H2S+CuSO4=CuS↓+H2SO4。但随后他陷入了困惑:这不是弱酸制得强酸了吗?与强酸制弱酸的规律矛盾了。请你帮助解释__________________________________________。
(4)氧化还原反应中也有类似规律:“强氧化性物质制弱氧化性物质”、“强还原性物质制弱还原性物质”,据此判断下列反应能够发生的是________(填字母编号)。
A.FeCl2+Cl2 FeCl3
FeCl3
B.Fe+I2 FeI3
FeI3
C.Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
D.FeCl3+Cu CuCl2+FeCl2
CuCl2+FeCl2
E.FeBr3+Cl2 FeCl2+Br2
FeCl2+Br2
F.FeI2+Br2 FeBr3+I2
FeBr3+I2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:填空题
甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。

①已知100°C时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________。
②图中的p1________p2(填“<”“>”或“=”),100°C时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
ⅰ | 150 | ? | 0.1 |
ⅱ | ________ | ________ | 5 |
ⅲ | 350 | ________ | 5 |
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
当把晶体N2O4放入恒容的密闭容器中,待全部气化并建立N2O4 2NO2平衡后,保持温度不变,再放入N2O4晶体并全部气化,待反应达到新的平衡,新平衡与旧平衡比较,其值减小的是( )
2NO2平衡后,保持温度不变,再放入N2O4晶体并全部气化,待反应达到新的平衡,新平衡与旧平衡比较,其值减小的是( )
A.c(NO2) B.c(N2O4) C. 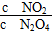 D.
D. 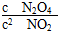
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
1 mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:
X(g)+aY(g) bZ(g)
bZ(g)
反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是( )
A.a=1,b=1 B.a=2,b=1
C.a=2,b=2 D.a=3,b=3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
某温度时,在体积为1 L的密闭容器中,A、B、C三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,B的体积百分含量与时间关系如图Ⅱ所示。则下列结论正确的是( )
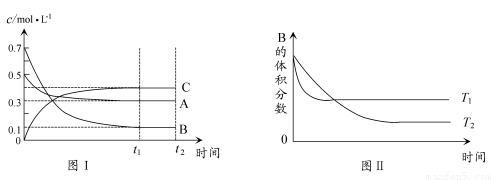
A.该反应的热化学方程式为 :A(g )+3B(g) 2C(g) ΔH>0
2C(g) ΔH>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向正反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率增大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:选择题
设C(s)+CO2(g) 2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g)
2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g) 2NH3(g);ΔH2<0反应速率为v2。
2NH3(g);ΔH2<0反应速率为v2。
对于上述反应,当温度降低时,v1和v2的变化情况为( )
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为 ( )
A.-488.3 kJ/mol B.+488.3 kJ/mol
C.-191 kJ/mol D.+191 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com