
 3R(g) △H>0,下图表示温度、压强的变化对上述反应的影响。下列表述正确的是
3R(g) △H>0,下图表示温度、压强的变化对上述反应的影响。下列表述正确的是 
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
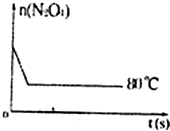


查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
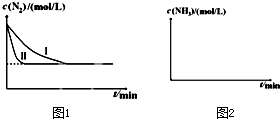
查看答案和解析>>
科目:高中化学 来源: 题型:
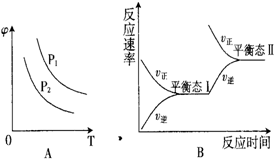 硫酸生产过程中关键阶段的反应为:
硫酸生产过程中关键阶段的反应为:| 催化剂 | 加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com