
分析 A在标况下的密度为1.161g•L-1,则相对分子质量为1.161×22.4=26,应为CH≡CH,则A、B、C、D四种有机物分子中碳原子数都为2,D在浓硫酸存在下发生消去反应生成B,可知D为CH3CH2OH,B为CH2=CH2,则C为CH3CH2Br,以此来解答.
解答 解:(1)A在标况下的密度为1.161g•L-1,则相对分子质量为1.161×22.4=26,应为CH≡CH,则A、B、C、D四种有机物分子中碳原子数都为2,D在浓硫酸存在下发生消去反应生成B,可知D为CH3CH2OH,B为CH2=CH2,则C为CH3CH2Br,
故答案为:CH≡CH;CH2=CH2;CH3CH2Br;CH3CH2OH;
(2)D→C为CH3CH2OH和HBr可发生取代反应生成CH3CH2Br,反应的方程式为C2H5OH+HBr$→_{△}^{浓H_{2}SO_{4}}$C2H5Br+H2O,
D→B为CH3CH2OH在浓硫酸存在下发生消去反应生成CH2=CH2,反应的方程式为C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,
故答案为:C2H5OH+HBr$→_{△}^{浓H_{2}SO_{4}}$C2H5Br+H2O;C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
点评 本题考查有机物的推断,为高频考点,把握利用密度推断A为解答的突破口,注意有机物的性质、有机反应,侧重分析与推断能力的考查,题目难度不大.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
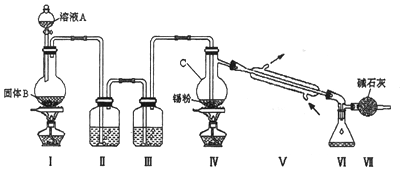
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥⑦ | B. | ①⑤ | C. | ②⑤⑦ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着工业发展和社会的进步,人们日益关注环境污染问题.
随着工业发展和社会的进步,人们日益关注环境污染问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的CO2通入NaClO溶液中发生反应:NaClO+CO2+H2O=NaHCO3+HClO,说明酸性强弱的顺序为H2CO3>HClO>HCO3- | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 浓H2SO4具有强氧化性,常温下就能与金属Cu发生剧烈反应 | |
| D. | NO2与H2O 反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2HCl═CuCl2+H2↑ | B. | Al2O3+3H2O═2Al(OH)3 | ||
| C. | Mg(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ MgO+H2O | D. | Ba(OH)2+SO2═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
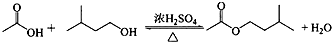
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com