
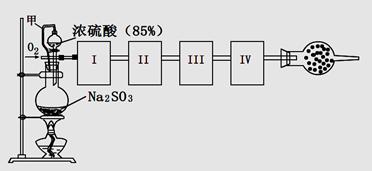
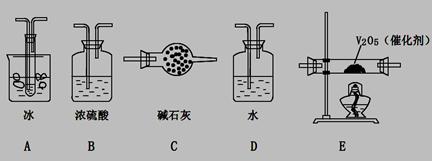


科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
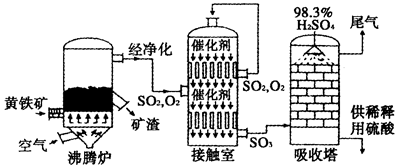
科目:高中化学 来源:不详 题型:单选题
| A.吸水性和酸性 | B.脱水性和吸水性 |
| C.强氧化性和吸水性 | D.不挥发性和酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
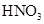 和
和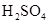 物质的量浓度分别为
物质的量浓度分别为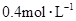 和
和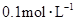 ,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中
,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中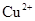 物质的量浓度(
物质的量浓度(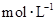 )为
)为| A.0.15 | B.0.225 | C.0.35 | D.0.45 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2SO4
H2SO4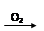 SO2
SO2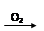 SO3
SO3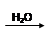 H2SO4
H2SO4| A.途径①反应中体现了浓HNO3的强氧化性和酸性 |
| B.途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本 |
| C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e- |
| D.途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可用浓硝酸除去铝制品表面的铜镀层 |
B.用催化法处理汽车尾气中的CO和NO:CO+NO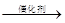 C+NO2 C+NO2 |
| C.浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体 |
| D.因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸滴到白纸上,白纸变黑 |
| B.浓硫酸暴露在潮湿的空气中,浓度变稀 |
| C.在浓硫酸中加入少量胆矾,胆矾变白色 |
| D.含水蒸汽的氢气通过浓硫酸后,氢气变干燥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com