
分析 (1)AlCl3为强酸弱碱盐,Al3+水解溶液呈酸性,氯化铝溶液蒸干,水解生成的氯化氢挥发,水解正向进行得到水解产物氢氧化铝,灼烧得到氧化铝;
(2)Na2CO3为强碱弱酸盐,CO3 2-水解:CO32-+H2O?HCO3-+OH-,使溶液呈碱性.
解答 解:(1)AlCl3为强酸弱碱盐,Al3+水解:Al3++3H2O?Al(OH)3+3H+,溶液呈酸性,氯化铝溶液蒸干,水解生成的氯化氢挥发,水解正向进行得到水解产物氢氧化铝,灼烧得到氧化铝;
故答案为:酸;Al3++3H2O?Al(OH)3+3H+;Al2O3;
(2)Na2CO3为强碱弱酸盐,CO3 2-离子水解:CO32-+H2O?HCO3-+OH-,使溶液呈碱性,将该溶液加热蒸干灼烧可得到碳酸钠固体,
故答案为:碱;CO32-+H2O?HCO3-+OH-;Na2CO3.
点评 本题考查了盐类水解的基础应用、溶液酸碱性判断、蒸干溶液产物判断等知识,题目较简单,侧重于基础知识的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 家用电器起火,常用液态CO2灭火,一般不用液态四氯化碳 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 | |
| D. | 实验后,剩余的药品不能随便丢弃(或浪费),应放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入标准状况下HCl气体11.2L,可使1 L浓度为0.5mol/L的盐酸物质的量浓度增大到1mol/L | |
| B. | 在10%的NaOH溶液中,平均每9个水分子溶有1个OH- | |
| C. | 将10g碳酸钙粉末加水配成100mL溶液,CaCO3物质的量浓度为1mol/L | |
| D. | 4g NaOH溶解在10mL水中,再稀释成1L,从中取1mL,这1mL溶液的物质的量浓度为0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
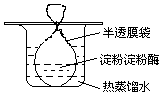 把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.
把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①② | B. | ②①③ | C. | ①②③ | D. | ②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| B. | 不能用燃着的酒精灯去点燃另一酒精灯 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 加完药品后应将滴管洗净后再放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在0-50min之间,pH=2和pH=7时R的降解百分率不相等 | |
| B. | 溶液酸性越强,R的降解速率越小 | |
| C. | R的起始浓度和溶液的pH均影响R的降解速率 | |
| D. | 在 20-25min之间,pH=10 时R的平均降解速率为 0.04mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com