
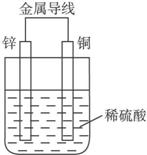
图11-2
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
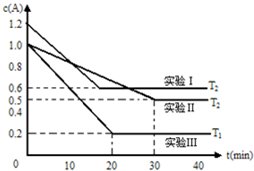 恒容体系,发生如下反应2A(g)?B(g)+xC(?)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
恒容体系,发生如下反应2A(g)?B(g)+xC(?)△H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):| c(B)?c(C) |
| c2(A) |
| c(B)?c(C) |
| c2(A) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学方程式 | 平衡常数K |
| F2+H22HF | 6.5×1095 |
| Cl2+H22HCl | 2.6×1033 |
| Br2+H22HBr | 1.9×1019 |
| I2+H22HI | 8.7×102 |
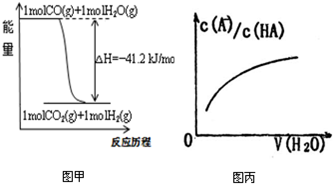
| A、已知CO的燃烧热283kJ/mol,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?Lˉ1 | ||
| C、在常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱 | ||
D、图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| [CO] | [CO2] |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省唐山市高三上学期期末统一考试理综试题化学试卷(解析版) 题型:选择题
(15分)在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
(1)铜与浓硫酸反应,实验装置如图所示。

①装置A中发生反应的化学方程式为 ;
②上图装置中导管B的作用你认为可能是(写出一种) 。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在 (填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过 、 、过滤、洗涤、干燥,即可得到产品CuSO4·5H2O晶体,干燥需要控制温度小于100℃,若温度过高,则会导致 。
(3)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量:FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu=2Fe2++Cu2+,请写出其第l步反应的离子方程式 。
(4)制取的CuSO4溶液和“另一物质”在40-50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 ,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是 (已知Cu+在酸性条件下发生反应2Cu+=Cu2++Cu)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com