
| A. | A→B | B. | B→C | C. | C→D | D. | D→E |
分析 浓盐酸可与二氧化锰在加热条件下反应生成Cl2,Cl2可与石灰乳反应生成Ca(ClO)2,Ca(ClO)2与酸反应可生成HClO,注意HClO的酸性比碳酸弱的特点,以此解答.
解答 解:A.浓HCl与二氧化锰在加热的条件下能产生Cl2,可直接实现HCl至Cl2的转化,故A正确;
B.Cl2与氢氧化钙反应生成CaCl2、Ca(ClO)2和H2O,可直接实现Cl2至Ca(ClO)2的转化,故B正确;
C.Ca(ClO)2能与H2O和二氧化碳反应生成碳酸钙和次氯酸(HClO),可直接实现Ca(ClO)2至HClO的转化,故C正确;
D.因HClO的酸性弱于碳酸,所以不能直接实现HClO至CO2的转化,故D错误.
故选D.
点评 本题考查含氯化合物的性质,为高频考点,熟练掌握常见物质的性质及变化规律,是解答此类问题的知识基础,明确“直接实现”的意义则是解答问题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Be2+离子中的质子和电子 | B. | H原子中的中子和质子 | ||
| C. | NaHCO3晶体中的阳离子和阴离子 | D. | Na2O2固体中的阴离子和阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
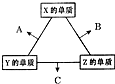 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为HNO3、NH4NO3、NH3.H2O.
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为HNO3、NH4NO3、NH3.H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
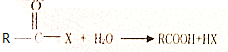
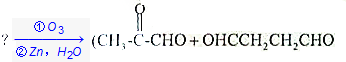

 .
.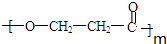 +(m-1)H2O.②B-C、C-E的反应类型分别为:加成反应、缩聚反应.
+(m-1)H2O.②B-C、C-E的反应类型分别为:加成反应、缩聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逐渐减小 | B. | 逐渐增大 | ||
| C. | 先逐渐增大,后逐渐减小 | D. | 先逐渐减小,后逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时,Ⅰ途径的反应速率V(A)等于Ⅱ途径的反应速率V(A) | |
| B. | 达到平衡时,第Ⅰ条途径混合气体的密度与第Ⅱ条途径混合气体的密度相同 | |
| C. | Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数相同 | |
| D. | Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,反应中NaH作为还原剂.
,反应中NaH作为还原剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com