
下列说法正确的是( )
|
| A. | △H<0、△S>0的反应在温度低时不能自发进行 |
|
| B. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
|
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
|
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
考点:
反应热和焓变.
专题:
化学反应中的能量变化.
分析:
A、依据反应自发进行的判断依据是△H﹣T△S<0分析判断;
B、反应是熵增大的反应,自发进行的反应,判断依据△H﹣T△S<0分析判断
C、反应自发进行需要由焓变和熵变温度共同决定;
D、催化剂改变反应速率,不能改变化学平衡;
解答:
解:A、△H<0、△S>0的反应,△H﹣T△S<0在任何温度都能自发进行,故A错误;
B、反应△H>0、△S>0,能自发进行说明,△H﹣T△S<0,原因是体系有自发地向混乱度增加的方向转变的倾向,故B正确;
C、反应自发进行需要由焓变和熵变温度共同决定,故C错误;
D、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应速率,但不能改变化学平衡和反应方向,故D错误;
故选B.
点评:
本题考查了反应自发进行的判断依据,化学平衡影响因素的分析判断,题目较简单.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为________,1 mol Y2X2含有σ键的数目为________。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是________。
 (3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是________。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是________。
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯
化物的化学式是________,它可与浓盐酸发生非氧化还
原反应,生成配合物HnWCl3,反应的化学方程式为
_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
表明金属甲比金属乙活动性强的叙述正确的是()
A. 在氧化还原反应中,甲失的电子比乙多
B. 同价态阳离子,甲比乙氧化性强
C. 将甲和乙用导线相连接,一同放入CuSO4溶液中,乙的表面有红色的铜析出
D. 将甲、乙组成原电池时,甲为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4A(g)+5B(g)⇌4C(g)+6D(g) 在5L的密闭容器中进行反应,30min后,C的物质的量增加了0.30mol.下列叙述正确的是()
A. 30min中A的平均反应速率是0.010mol•L﹣1•min﹣1
B. 容器中D的物质的量一定增加了0.45mol
C. 容器中A、B、C、D的物质的量的比一定是4:5:4:6
D. 容器中A的物质的量一定增加0.30mol
查看答案和解析>>
科目:高中化学 来源: 题型:
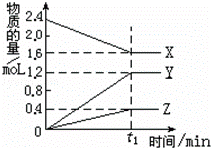
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
(1)①该反应的化学方程式.
②在t1min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为2:3
C.生成3mol Y的同时生成1mol Z
D.生成1mol Z的同时生成2mol X
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1min时,该反应吸收的热量为:;在此t1min时间内,用H2表示反应的平均速率v(H2)=.
②两位同学讨论放热反应和吸热反应.甲说加热后才能发生的化学反应是吸热反应,乙说反应中要持续加热才能进行的反应是吸热反应.你认为他们说法正确的是同学.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,属于水解反应的是( )
|
| A. | HCO3﹣+H2O⇌H3O++CO32﹣ | B. | HCO3﹣+H2O⇌H2CO3+OH﹣ |
|
| C. | CO2+H2O⇌HCO3﹣+H+ | D. | CH3COOH⇌CH3COO﹣+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组混合物中,都能用分液漏斗的是( )
|
| A. | 乙酸乙酯和水 酒精和水 苯酚和水 |
|
| B. | 溴乙烷和水 溴苯和水 硝基苯和水 |
|
| C. | 甘油和水 己烷和水 甲酸和水 |
|
| D. | 苯和甲苯 乙醛和水 乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是()
A. 25℃时,pH=13的氨水中含有OH﹣的数目为0.1NA
B. 标准状况下,2.24 LNO2 与水反应生成NO3﹣的数目为0.1NA
C. 1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA
D. 4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com