
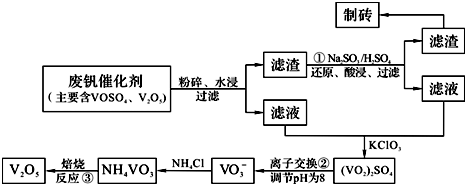
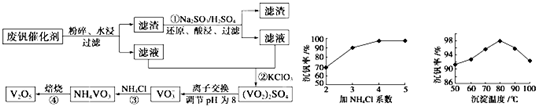
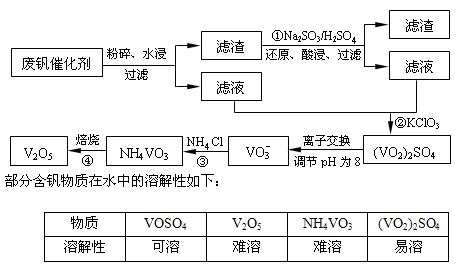
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺。己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
|
物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |

该工艺的主要流程如下:
请回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其反应的化学方程式为 。
(2)反应①的目的是 。
(3)若用NaOH溶液调节pH,则转化②的离子方程式为 。
(4)实验室中实现反应③所需主要仪器除三脚架、泥三角、酒精灯外,必不可少的是 。
(5)V2O5为硫酸工业接触室中的重要催化剂,其催化反应为2SO2(g)+O2(g) 2SO3(g)
ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g)
ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为 。
。
①该条件下反应2SO2(g)+O2(g) 2SO3(g)
的平衡常数为_____;
2SO3(g)
的平衡常数为_____;
②下列措施能使 增大的是_____。
增大的是_____。
A.升高温度
B.保持温度和容积不变,再充入2 mol He
C.保持温度和容积不变,再充入2 mol SO2和1 mol O2
D.不用V2O5作催化剂,改用其它更高效催化剂
(14分)(1)3V2O5+10Al 6V+5Al2O3(2分);(2)将V2O5转化为可溶的VOSO4(2分)
6V+5Al2O3(2分);(2)将V2O5转化为可溶的VOSO4(2分)
⑶VO2++2OH-=VO3-+H2O(3分) ⑷坩埚(2分); ⑸1620(3分);C(2分)
【解析】
试题分析:(1)铝是活泼的金属,能和金属氧化物发生铝热反应,所以铝和五氧化二钒发生铝热反应的化学方程式为3V2O5+10Al 6V+5Al2O3。
6V+5Al2O3。
(2)根据溶解性表知,滤渣是V2O5,酸性条件下,V2O5和亚硫酸钠发生氧化还原反应生成可溶性的VOSO4,所以反应①的目的是将V2O5转化为可溶的VOSO4。
(3)VOSO4有强氧化性,能把氯酸钾氧化,自身被还原成(VO2)2SO4。在碱性条件下,VO2+转化为VO3-,反应的离子方程式是VO2++2OH-=VO3-+H2O。
(4)固体加热需要在坩埚中进行,因此必不可少的是坩埚。
(5)①
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
起始浓度(mol/L) 1.0 0.5 0
转化浓度(mol/L) 2x x 2x
平衡浓度(mol/L) 1.0-2x 0.5-x 2x
一定条件下达到平衡,SO3的体积分数为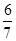
则有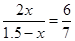
解得x=0.45
所以该温度下可逆反应的平衡常数K= =
=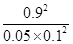 =1620
=1620
②A.正方应是放热反应,则升高温度平衡向逆反应方向移动,因此 减小;
减小;
B.保持温度和容积不变,再充入2 mol He,反应物和生成物的浓度不变,平衡不移动,因此 不变;
不变;
C.保持温度和容积不变,再充入2 mol SO2和1 mol O2,相当于是增大压强,平衡向正方应移动,因此 增大;
增大;
D.催化剂只能改变反应速率,但不能改变平衡状态,因此不用V2O5作催化剂,改用其它更高效催化剂使, 不变,答案选C。
不变,答案选C。
考点:考查铝热反应、反应条件的控制与选择、仪器的选取、平衡常数的计算以及外界条件对平衡状态的影响等


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
| ||
| ||
| 6 |
| 7 |
| n(SO3) |
| n(SO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
+ 2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省内江市高三第二次模拟考试理综化学试卷(解析版) 题型:计算题
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质在水中的溶解性如下:

回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热法,该反应的化学方程式为_______
(2)为了提高钒的浸出率,用酸浸使催化剂中的V2O5转变成可溶于水的VOSO4,与水浸液合并,再用KClO3氧化,使+4价的V氧化成易溶于水的(VO2)2SO4。反应①的离子方程式为_______;反应②的离子方程式为ClO3-+6VO2++3H2O=6VO2++6H++Cl-。
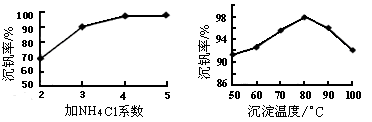
(3)该工艺中反应③的沉淀率是回收钒的关键之一,该步反应的离子方程式为_______。
(4) 实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100g该废钒催化剂按工业生产的步骤进行实验,当加入100 mL 0.1 mol·L-1的KC1O3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是_______ (已知V2O5的相对分子质量为182)。
(5) 全钒液储能电池是利用不同价态的离子对之间的氧化还原反应来实现化学能和电能相互 转化的装置,其原理如右下图所示。已知电池的总反应式为VO2++V2++2H+ VO2++V3++H2O
VO2++V3++H2O

①放电时的正极反应式为______________。
②放电过程中氢离子的作用是______________,充电时若转移的电子为2mol,则左槽溶液中n(H+)的变化量为______________。
查看答案和解析>>
科目:高中化学 来源:广东省模拟题 题型:填空题
 VO2++H2O+V3+,电池放电时正极的电极反应式为___________。
VO2++H2O+V3+,电池放电时正极的电极反应式为___________。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com