
| A. | I-、Br-、Cl- | B. | Br-、Cl-、I- | C. | Cl-、I-、Br- | D. | Br-、I-、Cl- |
分析 氯水中的氯气具有氧化性,能将Br-、I-离子氧化为其单质,溴单质水溶液颜色为棕黄色,碘的水溶液为紫色,再将此溶液倒入试管C中,无明显现象,说明不反应,以此解答该题.
解答 解:已知氧化性Cl2>Br2>I2,向A中加淀粉溶液和新制的Cl2水变为橙色,发生的反应为:2Br-+Cl2═Br2+2Cl-,说明A中含有Br-,再将此溶液(含有溴单质)倒入C试管中,无变化,证明C中一定不含I-,则C中含有Cl-,所以B中含有I-,则A、B、C三支试管中所盛有的离子依次是Br-、I-、Cl-.
故选D.
点评 本题考查卤素元素的性质,为高频考点,侧重于学生的分析、实验能力的考查,题目难度不大,本题注意把握卤素单质的氧化性强弱,为解答该题的关键,根据反应现象可判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 前四周期中最外层电子数大于或等于3的元素一定是主族元素 | |
| B. | 冰中水分子空隙大于4℃液态水、近沸点水蒸汽中存在(H2O)n与形成配位键有关 | |
| C. | 化合物中某元素为+1价,则表明失去了1个电子且带1个单位正电荷 | |
| D. | 在化学反应中,原子首先失去的电子能量最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应完全停止 | B. | 反应达到平衡状态 | ||
| C. | 反应物消耗完全 | D. | 正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
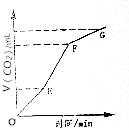 (1)下列说法中,不正确的是DEHIJ
(1)下列说法中,不正确的是DEHIJ查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和苯都能发生取代反应 | |
| B. | 甲烷和乙烯通常都是气体,可用溴水进行鉴别 | |
| C. | 甲烷和苯都无还原性,乙烯有还原性 | |
| D. | 乙烯和苯都能与氢气发生加成反应,反应产物都属于烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的负极材料可选用多空隙的石墨 | |
| B. | 电池的正极反应为:3SOCl2+8e-═SO${\;}_{3}^{2-}$+2S+6Cl- | |
| C. | 电池的电解质溶液可选用稀盐酸 | |
| D. | 上述反应中,每转移4mol电子,生成氧化产物32g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
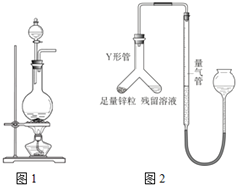 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com