
如图所示,6个编号分别代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应(已知高温下氨能还原氧化铁):a. Al; b.Fe2O3; c.NaOH溶液; d. HI溶液;e.NH3 ;f.Cl2 。图中⑤表示的物质是( )

A.a或b B.c C.d D.e或f
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源:2016届河南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
在标准状况下,将aLNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为Cmol/L。下列叙述中正确的是
①ω=
②C=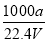
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-) > c(NH4+) > c(H+) > c(OH-)
A、①④ B、②③ C、①③ D、②④
查看答案和解析>>
科目:高中化学 来源:2015-2016河北石家庄第一中学高一上期中考试化学试卷(解析版) 题型:选择题
下列溶液中,与200mL 0.5mol/L MgCl2溶液所含的Cl-物质的量浓度相同的是
A.100mL 0.25mol/L CaCl2溶液
B.50ml 1mol/L KCl溶液
C.50ml 0.5mol/L NaCl溶液
D.200mL 0.25mol/L AlCl3溶液
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
阴离子 | NO3- CO32- SiO32- SO42- OH- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的离子是____ ____。
(2)实验Ⅰ中生成沉淀的离子方程式为___________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)。
阴离子 | 浓度c/(mol·L-1) | |
① | ||
② | ||
③ | ||
④ |
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:________ _____。
查看答案和解析>>
科目:高中化学 来源:2016届山西康杰中学等四校高三上第二次联考理化学试卷(解析版) 题型:填空题
阿司匹林口服时,具有解热镇痛作用。是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄。近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成。它的有效成分是乙酰水杨酸(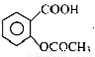 )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
【反应原理及部分装置】
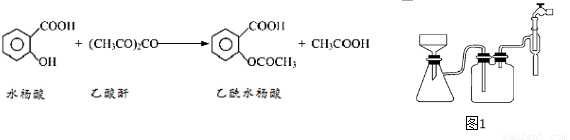
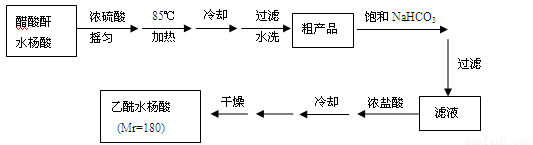
【实验流程】
已知:①醋酸酐遇水分解生成醋酸。
②水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,副产物为高分子化合物,难溶于水。
回答下列问题:
(1)合成过程中要控制温度在85℃~90℃,最合适的加热方法______。
(2)用图1装置过滤比普通漏斗过滤的优点是______________________。
(3)粗产品提纯:
①分批用少量饱和NaHCO3溶液溶解粗产品,目的是_______;判断该过程结束的现象是___________。
②加浓盐酸、冷却后的操作是__________、______、干燥、称重、计算产率。
③纯度检验:取少许产品加入盛有2 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色。可能的原因是_____________。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品mg;
Ⅱ.将样品研碎,溶于V1 mL a mol/LNaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol/L的标准盐酸滴定剩余的NaOH,消耗盐酸的体积为V2 mL。
已知 乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式:

则阿司匹林药片中乙酰水杨酸质量分数的表达式为:____________________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏常州一中、江阴南菁高中高三两校联考化学卷(解析版) 题型:选择题
在2L密闭容器内,按物质的量之比为2︰1投入NO和O2。某温度下发生如下反应:
2NO(g) + O2(g) 2NO2(g),n(NO)随时间的变化如表:
2NO2(g),n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.015 | 0.012 | 0.010 | 0.010 | 0.010 |
下列说法不正确的是
A.在0~2s内,v(O2)=0.002mol·L-1·s-1
B.5s后向容器中通入0.02mol NO2,再次平衡后,0.020mol<n(NO2)<0.040 mol
C.在该温度时,向容器中加入O2,平衡将正向移动,平衡常数增大
D.5s后,向反应容器中同时通入各0.01mol的NO、O2、NO2,平衡向正向移动
查看答案和解析>>
科目:高中化学 来源:2016届湖南师范大学附属中学高三上月考(四)化学试卷(解析版) 题型:选择题
下列应用不涉及氧化还原反应的是
A.铝热法冶炼难熔金属
B.工业上电解熔融状态Al2O3制备Al
C.Na2O2用作呼吸面具的供氧剂
D.实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源:2016届贵州遵义航天高级中学高三第四次模拟考试理化学卷(解析版) 题型:推断题
有机物J的分子式为C10H12O3,是一种重要的化工原料,可用作溶剂、催化剂、塑料助剂以及合成医药、农药等。目前,我国有关J的用途是作为农药胺硫磷、甲基异柳磷的中间体。下图是这种有机物的合成方案:

已知:有机物I中有两个化学环境相同的甲基。
请回答下列问题:
(1)写出下列反应的反应类型:①___________,③_____________。
(2)写出反应④的化学方程式:_____________________。
(3)J的结构简式为_____________。
(4)反应①所起的作用是_____________。
(5)H的核磁共振氢谱共有________个吸收峰,其面积之比为____________。
(6)下列有关E的性质的说法,正确的是____________。
a.能使酸、碱指示剂变色
b.能使FeCl3溶液显色
c.与纯碱溶液混合无现象
d.难溶于水
e.1mol该有机物与足量钠反应可产生标况下氢气22.4L
(7)满足下列条件且与有机物J互为同分异构体的有机物共有_________种,任写出其中一种的结构简式:_______。
A.苯环上仅有两个对位取代基
B.能发生水解反应
C.遇浓溴水能发生反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏石嘴山第三中学高二上期中考试化学卷(解析版) 题型:选择题
苯酚和苯甲醇共同的化学性质是( )
A.具有酸性 B.与钠反应放出氢气
C.遇FeCl3溶液显紫色 D.与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com