
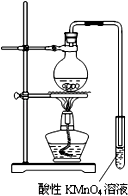
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.分析 (1)从反应装置出来的气体除了生成的乙烯外还有挥发出来的乙醇,所以使酸性KMnO4溶液颜色褪去不一定是产生的乙烯在作用;
(2)根据(1)的分析,只要在通入酸性KMnO4溶液之前除去乙醇就可以证明乙烯的生成了;
(3)根据改进实验装置后,溶液颜色褪色不明显,说明生成的乙烯量很少,结合资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%不难分析原因;
(4)根据资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快,说明要产生乙烯要控制温度在90℃~110℃,所以需要一个量程为200℃温度计,再根据资料三:溴乙烷的沸点:38.2℃,所以在制得的乙烯中会含有溴乙烷气体的杂质,需要冷凝除去,所以需要冷凝管.
解答 解:(1)因为乙醇具有挥发性,所以从反应装置出来的气体除了生成的乙烯外还有挥发出来的乙醇,乙烯和乙醇都可以使酸性KMnO4溶液颜色褪去,故不一定是产生的乙烯,
故答案为:乙醇易挥发,挥发出来的乙醇也可以使酸性KMnO4溶液褪色;
(2)根据(1)的分析,只要在通入酸性KMnO4溶液之前除去乙醇就可以证明乙烯的生成了,除去乙醇最简单的方法就是通入水中而且又不影响乙烯,
故答案为:在小试管之前增加一个盛有冷水的洗气瓶;
(3)根据改进实验装置后,溶液颜色褪色不明显,说明生成的乙烯量很少,结合资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%,所以应该是反应温度较低主要发生了取代反应,方程式为CH3CH2Br+NaOH$\stackrel{55℃}{→}$CH3CH2OH+NaBr,
故答案为:反应温度较低;CH3CH2Br+NaOH$\stackrel{55℃}{→}$CH3CH2OH+NaBr;
(4)根据资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快,说明要产生乙烯要控制温度在90℃~110℃,所以需要一个量程为200℃温度计,再根据资料三:溴乙烷的沸点:38.2℃,所以在制得的乙烯中会含有溴乙烷气体的杂质,需要冷凝除去,所以需要冷凝管,
故答案为:冷凝管(或者用较长的导气管);量程为200℃温度计.
点评 本题通过探究溴乙烷的消去反应的条件及验证产物,考查了物质性质实验方案的设计,题目难度中等,正确分析题干信息为解答关键,注意掌握物质性质实验方案的设计原则,试题侧重考查学生的分析、理解能力及综合应用所学知识的能力.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 人们研究金星大气成分,发现金星大气中有一种称之为羰基硫(COS)的分子,已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法正确的是( )
人们研究金星大气成分,发现金星大气中有一种称之为羰基硫(COS)的分子,已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法正确的是( )| A. | 羰基硫属于非极性分子 | |
| B. | 羰基硫的电子式为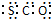 | |
| C. | 羰基硫的沸点比CO2低 | |
| D. | 羰基硫分子中三个原子处于同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、Cl-、NO3- | B. | Pb2 +、Hg2 +、S2 -、SO42 - | ||
| C. | NH4+、H+、S2O32-、PO43- | D. | ClO-、Al3 +、Br-、CO32 - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Z>W>Y>X | |
| B. | Y的最高价氧化物对应的水化物可与其气态氢化物发生化合反应 | |
| C. | 气态氢化物的稳定性Z>W | |
| D. | X与Y的最高正化合价之和的数值等于10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
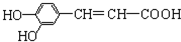 下列有关咖啡酸的说法中,不正确的是( )
下列有关咖啡酸的说法中,不正确的是( )| A. | 1 mol咖啡酸可与3 mol NaOH发生反应 | |
| B. | 咖啡酸可以发生还原、酯化、加聚、显色等反应 | |
| C. | 1 mol咖啡酸可与4 mol Br2发生反应 | |
| D. | 1 mol咖啡酸最多可与5 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 软锰矿 | 闪锌矿 |
| MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分 | ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分 |
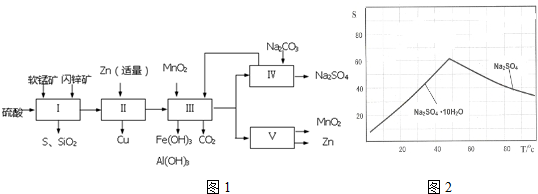
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 7.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com