
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | FeCl3+3KSCN?3KCl+Fe(SCN)3 体系中加入KCl固体,平衡向逆反应方向移动 |
分析 A、物质发生化学反应的同时,伴随着能量变化;
B、吸热反应生成物全部化学键形成时所释放的能量小于破坏反应物全部化学键所吸收的能量;
C、反应热的大小与反应的条件无关;
D、根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变.
解答 解:A、因物质发生化学反应的同时,一定伴随着能量变化,故A错误;
B、因吸热反应生成物全部化学键形成时所释放的能量小于破坏反应物全部化学键所吸收的能量,而生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为放热反应,故B错误;
C、反应热的大小与反应的条件无关,所以同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同,故C正确;
D、氯离子不参与反应,平衡不移动,故D错误;
故选:C.
点评 本题考查化学变化特征、影响反应速率的因素等,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
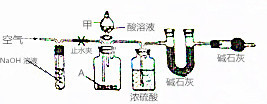 碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑦ | B. | ②⑥⑦ | C. | ①④⑧ | D. | ④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的醋酸的导电能力比纯醋酸的导电能力弱 | |
| B. | PH均为5的盐酸和NH4Cl溶液中水电离出来的c(H+)均为1×10-5mol•L-1 | |
| C. | PH=8.3的NaHC03溶液中:c(Na+)>c(HCO3- )>c(CO32-)>c(H2CO3) | |
| D. | 向0.10mol•L-1 NaHSO3溶液中通入NH3至溶液的PH=7,此时溶液中:c(Na+)>c(SO32-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com