
【题目】常温下,向![]() 溶液中加入足量的镁条,该体系
溶液中加入足量的镁条,该体系![]() 随时间变化的曲线如图所示。实验观察到
随时间变化的曲线如图所示。实验观察到![]() 点开始溶液中有白色沉淀生成,已知
点开始溶液中有白色沉淀生成,已知![]() 。下列说法错误的是( )
。下列说法错误的是( )
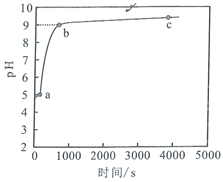
A.常温下,![]() 的水解平衡常数数量级为
的水解平衡常数数量级为![]()
B.体系中,水的电离程度大小关系为![]()
C.![]() 点时,溶液中
点时,溶液中![]()
D.![]() 点溶液中,
点溶液中,![]()
【答案】B
【解析】
A.常温下,氯化铵的水解平衡式为:NH4++H2ONH3H2O+H+,则Kh= ![]() ,由于氨水和氢离子浓度几乎相等,根据图像可知,没加镁之前,溶液的pH=5,c(NH3·H2O)≈c(H+)=10-5mol/L,c(NH4+)= 1mol/L,则Kh=
,由于氨水和氢离子浓度几乎相等,根据图像可知,没加镁之前,溶液的pH=5,c(NH3·H2O)≈c(H+)=10-5mol/L,c(NH4+)= 1mol/L,则Kh= ![]() =10-10,水解平衡常数数量级为
=10-10,水解平衡常数数量级为![]() ,故A正确;
,故A正确;
B.氯化铵的水解平衡式为:NH4++H2O NH3H2O +H+,加入镁单质时,消耗了氢离子,使平衡正向移动,促进铵根离子的水解,即促进了水的电离,故水的电离程度大小关系为c>b>a,故B错误;
C.![]() 点时,
点时,![]() ,pH=9,c(H+)=10-9mol/L,c(OH-)=10-5,c(Mg2+)=
,pH=9,c(H+)=10-9mol/L,c(OH-)=10-5,c(Mg2+)=![]() ,故C正确;
,故C正确;
D.![]() 点溶液中,电荷守恒式为:
点溶液中,电荷守恒式为:![]() ,故
,故
![]() ,故D正确;
,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】聚乙烯胺可用于合成染料 Y,增加纤维着色度,乙烯胺(CH2=CHNH2)不稳定,所以 聚乙烯胺常用聚合物 X 水解法制备。下列说法不正确的是
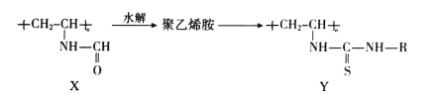
A. 聚合物 X 在酸性或碱性条件下发生水解反应后的产物相同
B. 测定聚乙烯胺的平均相对分子质量,可得其聚合度
C. 乙烯胺与 CH3CH=NH 互为同分异构体
D. 聚乙烯胺和 R-N=C=S 合成聚合物 Y 的反应类型是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol–1。若阿伏加德罗常数的数值用NA表示,则:
(1)该气体的物质的量为____________mol;
(2)该气体所含原子总数为_______________个
(3)该气体在标准状况下的体积为__________L;
(4)该气体在标准状况下的密度为____________g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
完成下列填空:
(1)C离子的结构示意图为___,D在周期表中位置是___。
(2)写出E的电子式:__。
(3)A、D两元素形成的化合物属___(填“离子”或“共价”)化合物,1mol该化合物含___mole-。
(4)写出D的最高价氧化物的水化物和A单质反应的化学方程式:___。
(5)元素硒(Se)被誉为“生命的奇效元素”,与D元素同主族,则下列关于硒的叙述错误的是___(填序号)。
a.Se元素的最高化合价为+6
b.硒的最高价氧化物对应水化物的化学式H2SeO3
c.硒的非金属性比氧元素弱
d.气态氢化物的热稳定性:H2Se>H2D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是某合成农药的中间体,其结构为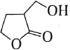 。下列有关的说法正确的是( )
。下列有关的说法正确的是( )
A.M能发生取代反应和加成反应
B.1molM与足量的NaOH溶液反应,最多可消耗2molNaOH
C.分子中有5个碳原子共平面
D.同时含有-CHO和-COOH结构的M的同分异构体有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是( )
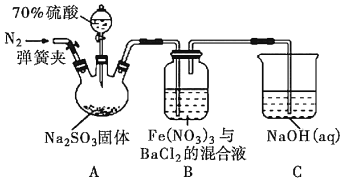
A.装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO![]()
B.实验室中配制加70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C.三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D.装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
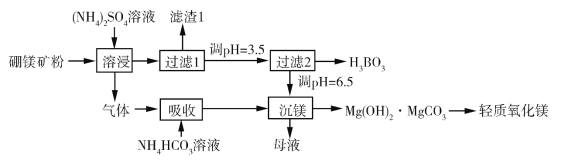
回答下列问题:
(1)在95 ℃“溶侵”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________。
(2)“滤渣1”的主要成分有_________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
H++B(OH)4,Ka=5.81×1010,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含![]() 、
、![]() 元素的物质在生产生活中有重要的用途。回答下列问题:
元素的物质在生产生活中有重要的用途。回答下列问题:
(1)基态![]() 核外电子排布式为________。
核外电子排布式为________。
(2)![]() 分子的立体构型为________。
分子的立体构型为________。
(3)某个![]() (Ⅱ)有机配合物的结构如图所示:
(Ⅱ)有机配合物的结构如图所示:

①该分子中N原子的杂化方式为________、________。
②请在图中用“![]() ”标出
”标出![]() 的配位键______。
的配位键______。
(4)Ge,As,Se元素处于同一周期,三种元素原子的第一电离能由大到小的顺序为________。
(5)![]() 的酸性强于
的酸性强于![]() 的原因是________,
的原因是________,![]() 的键角小于
的键角小于![]() 的原因是________。
的原因是________。
(6)如图为Ni和As形成的某种晶体的六方晶胞图,该化合物的化学式为________,Ni原子占据的空隙类型为________。已知晶胞参数分别为apm、apm、bpm和![]() ,则该品胞的密度为________
,则该品胞的密度为________![]() (设阿伏加德罗常数的值为NA)
(设阿伏加德罗常数的值为NA)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生命物质中重要的组成元素之一。含氮物质的使用既给人类带来福音,又给人们带来一些负面影响。
(1)肥料的三要素,除了氮还有____。
(2)NH3是氮的氢化物,它的空间构型是_____,属于____分子(填写“极性”或“非极性”),N原子的结构示意图是____。
(3)氨的水溶液叫做氨水,它可作为化学肥料。实际使用时,因为有很多不便,所以往往制成铵盐。NH4Cl就是常见的铵盐,NH4Cl属于___晶体,长期使用含NH4Cl的氮肥会使土壤___(填写“酸”或“碱”)化,请结合有关方程式说明原因____。
(4)工业上通常以铁触媒为催化剂,在500℃左右,20~50MPa下合成氨气。采用该压强的原因是____。
(5)含氮废水进入水体会对环境造成污染,某课题小组利用废铝将NO3-还原为N2,从而消除污染。其反应如下:6NO3-+10Al+18H2O→3N2↑+10Al(OH)3+6OH-,该反应中,还原剂是____,被还原的元素是____;每生成2molN2,转移的电子数是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com