
| A.加入10mL 0.01mol·L-1的NaOH溶液 |
| B.加入10mL 的水进行稀释 |
| C.加水稀释成100mL |
| D.加入10mL 0.01mol·L-1的盐酸溶液 |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:不详 题型:单选题
| A.开发利用太阳能、生物质能等清洁能源 |
| B.充分开发利用纯天然纤维,停止使用各种化学合成材料 |
| C.积极发展公共交通,倡导绿色出行 |
| D.研制开发燃料电池汽车 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用标准NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液——浅红色 |
| B.用标准FeCl3溶液滴定KI以测定其浓度:淀粉溶液——蓝色 |
| C.用标准酸性KMnO4溶液滴定Na2SO3溶液以测定其浓度:KMnO4溶液——紫红色 |
| D.利用“Ag++SCN-=AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液——红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
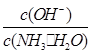 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1
NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1| A.随着盐酸的逐滴加入,水电离的c(OH—)总是逐渐减小 |
| B.当滴入10mL盐酸时,溶液中:c(NH4+)十c(NH3·H2O)=2c(Cl—) |
| C.当滴入20mL盐酸时,溶液中:c(Cl—)十c(H+)=c(NH4+)十c(OH—) |
D.水电离过程的热化学方程式可表示为:H2O(1)  H+(aq)+OH—(aq) ΔH=( b-a) kJ·mol-1 H+(aq)+OH—(aq) ΔH=( b-a) kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 =10-8,下列叙述正确的是
=10-8,下列叙述正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.y=2ax+b | B.y=ax/(2x+3a) | C.a/2y-3a/2x=1 | D.x=2ay/(a+y) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.均为0.10mol·L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者小于后者 |
| B.25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
| C.25℃时pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 |
| D.25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH< 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com