
| A. | 1L0.5mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA | |
| B. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| C. | 室温下,1L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| D. | ag某气体含分子数为b,c g该气体在标况下的体积为$\frac{22.4ab}{c{N}_{A}}$L |
分析 A.胶体为多个粒子的集合体;
B.依据电荷守恒解答;
C.依据酸、碱对水的电离产生抑制解答;
D.ag某气体的分子数为b,则cg气体中分子个数为$\frac{bc}{a}$,其体积V=$\frac{N}{N{\;}_{A}}$×Vm.
解答 解:A.胶体为多个粒子的集合体,所以1L0.5mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目小于为0.5NA,故A错误;
B.将1molNH4NO3溶于稀氨水中使溶液呈中性,则溶液中存在电荷守恒:n(NH4+)+n(H+)=n(OH-)+n(NO3-),则硝酸根离子个数等于铵根离子个数,故B正确;
C.室温下,1L pH=1的H2SO4溶液中,水的电离受到抑制,溶液中氢离子浓度为0.1mol/L,则由水电离产生的氢离子浓度等于由水电离产生的氢氧根离子浓度为:10-13mol/L,1L pH=1的H2SO4溶液中,由水电离出的H+数目为10-13NA,故C错误;
D.ag某气体的分子数为b,则cg气体中分子个数为$\frac{bc}{a}$,其在标况下的体积V=$\frac{N}{N{\;}_{A}}$×Vm=$\frac{22.4bc}{aN{\;}_{A}}$,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大,注意溶液中电荷守恒规律的应用.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ/mol | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,浓H2SO4与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用钠可以检验某无水酒精中是否含有水 | |
| B. | 140℃时,无水乙醇与浓硫酸共热可制备乙烯 | |
| C. | 制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸 | |
| D. | 在蔗糖溶液中加入少量稀硫酸,水浴加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,没有砖红色沉淀生成,说明蔗糖没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
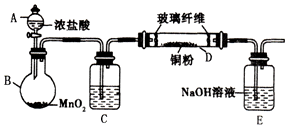 实验室采用如图所示的装置制取氯化铜(部分仪器和夹持装置已略去).
实验室采用如图所示的装置制取氯化铜(部分仪器和夹持装置已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与液溴FeBr3作催化剂的条件下发生取代反应,生成溴苯 | |
| B. | 分子式为C5H10Q2,且能与NaHCO3反应的有机物有3种 | |
| C. | 乙醇制备乙烯和乙醇制备乙酸乙酯均为取代反应 | |
| D. | 2-甲基戊烷和4-甲基戊烷互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com