科学家一直致力于“人工固氮”的新方法研究.据报道:在常温、常压、光照条件下,N
2在催化剂(掺有少量Fe
2O
3的TiO
2)表面与水发生反应,生成的主要产物为NH
3和O
2.
(1)已知:①H
2(g)+
O
2(g)═H
2O(l)△H
l=-285.6kJ/mol
②N
2(g)+3H
2(g)?2NH
3(g)△H
2=-92.2kJ/mol
写出此条件下氮气和水反应的热化学方程式
.
(2)氨可用于工业制硝酸,其主反应为:4NH
3(g)+5O
2(g)?4NO(g)+6H
2O(g)△H<0,此反应的化学平衡常数表达式为
,若此反应起始的物质的量相同,则如图所示的关系图正确的是
(填序号)
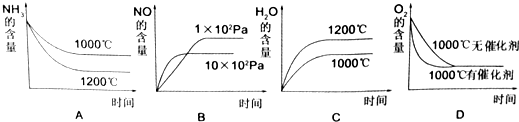
在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 |
c(NH3)(mol/L) |
c(O2)(mol/L) |
c(NO)(mol/L) |
| 起始 |
0.8000 |
1.600 |
0.000 |
| 第2min |
0.6000 |
a |
0.2000 |
| 第4min |
0.3000 |
0.9750 |
0.5000 |
| 第6min |
0.3000 |
0.9750 |
0.5000 |
| 第8min |
0.7000 |
1.475 |
0.1000 |
①反应在第2min到第4min时,O
2的平均反应速率为
mol?L
-1?min
-1.
②反应在第2min时改变了条件,改变的条件可能是
.
③在第6min时,改变了反应的条件,该平衡向
移动(填“左”或“右”).




 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案

 。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算
。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算  的平衡常数。
的平衡常数。