
分析 (1)碳酸钠溶液水解显碱性,油污在碱溶液中发生水解生成溶于水的醇和盐,容易洗去;
(2)水解的盐促进水的电离,酸碱抑制水的 电离,盐水解程度越大,水的电离平衡程度越大,弱酸碱抑制水电离程度小于强酸强碱;
(3)一水合氨溶液中存在电离平衡,加入氯化铵固体溶解后,铵根离子浓度增大,平衡逆向进行;
(4)等体积混合③HCl ④NH3•H2O,生成氯化铵溶液,溶液中存在物料守恒,氮元素守恒,铵根离子水解溶液显酸性判断溶液中离子浓度大小,若将③和④的溶液混合后溶液恰好呈中性,需要一水合氨多,据此分析溶液体积;
(5)取10mL溶液③,加水稀释到100mL,溶液浓度为原来的$\frac{1}{10}$,为0.01mol/L.
解答 解:(1)碳酸钠溶液水解显碱性,离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(2)①Na2CO3 ②NaHCO3 盐溶液中阴离子水解促进谁的电离,水的电离程度增大,碳酸根离子水解程度大于碳酸氢根离子,则水的电离程度①>②,③HCl ④NH3•H2O是酸和碱,抑制水的电离,一水合氨为弱碱对水抑制沉淀小,水电离程度④>③,则四种溶液中水的电离程度由大到小的顺序是①②④③,
故答案为:①②④③;
(3)一水合氨溶液中存在电离平衡,加入氯化铵固体溶解后,铵根离子浓度增大,平衡逆向进行,氢氧根离子减小,一水合氨增大,比值减小,
故答案为:减小;
(4)等体积混合③HCl ④NH3•H2O,生成氯化铵溶液,溶液中存在物料守恒,氮元素守恒,此时溶液中[NH4+]+[NH3•H2O]=0.05mol/L,溶液中铵根离子水解溶液显酸性判断溶液中离子浓度大小为:[Cl-]>[NH4+]>[H+]>[OH-],若将③和④的溶液混合后溶液恰好呈中性,需要一水合氨多,一水合氨溶液体积略大,则混合前③的体积小于④的体积,
故答案为:0.05;[Cl-]>[NH4+]>[H+]>[OH-];小于;
(5)取10mL溶液③,加水稀释到100mL,溶液浓度为原来的$\frac{1}{10}$,为0.01mol/L,由Kw=c(OH-)•c(H+)可知,c(OH-)=10-12 mol•L-1,则此时溶液中由水电离出的c(H+)=10-12 mol•L-1,
故答案为:10-12.
点评 本题考查较为综合,涉及弱电解质的电离和盐类的水解、电解质溶液中离子浓度大小、溶液酸碱性判断等问题,综合考查学生的化学知识应用能力和分析能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 过滤时,用玻璃棒搅动滤纸中的液体 | |
| B. | 做钠的焰色反应实验可用玻璃棒蘸取少量NaCl的浓溶液在无色火焰上灼烧 | |
| C. | 配制溶液过程中定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线 | |
| D. | 用自来水制蒸馏水时,弃去开始馏出的部分液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠元素性质活泼,不可能应用在电光源上 | |
| B. | 漂白粉的有效成分是Ca(ClO)2 | |
| C. | 浓硝酸可以盛放在铝制容器中 | |
| D. | 向3mL1mol/L的碳酸钠溶液中逐滴滴入稀盐酸,起初并无气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a=b | C. | a<b | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 | |
| B. | 0.1 mol•L-1醋酸溶液中:c2(H+)=c(H+)•c(CH3COO-)+KW | |
| C. | 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示,当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)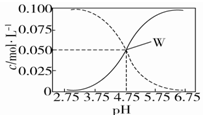 | |
| D. | 在25℃时,将c mol•L-1的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O=2Cu↓+O2↑+4H+ | |
| B. | 惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑ | |
| C. | 乙醛溶液中加入新制碱性Cu(OH)2悬浊液并加热CH3CHO+2 Cu(OH)2+OH-$\stackrel{△}{→}$ CH3COO-+Cu2O↓+3H2O | |
| D. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③⑤⑥ | C. | ③⑤ | D. | ②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HI生成的速率与分解的速率相等 | |
| B. | 单位时间内消耗a mol H2,同时生成2a mol HI | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的物质的量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | NaCl | C. | Na2CO3 | D. | Na2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com