
【题目】在2A+B3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 molL﹣1s﹣1
B.v(B)=0.3 molL﹣1s﹣1
C.v(C)=0.8 molL﹣1s﹣1
D.v(D)=1.6 molL﹣1min﹣1
【答案】B
【解析】解:对于反应 2A+B3C+4D,都转化为D表示的速率进行比较,A.v(A)=0.5 mol/(Ls)=30mol/(Lmin),反应速率之比等于其计量数之比,故V(D)=2V(A)=60mol/(Lmin);
B.v(B)=0.3 mol/(Ls)=18mol/(Lmin);反应速率之比等于其计量数之比,故V(D)=4V(B)=72mol/(Lmin);
C.V(C)=0.8 mol/(Ls)=48mol/(Lmin),反应速率之比等于其计量数之比,故V(D)= ![]() V(A)=64mol/(Lmin);
V(A)=64mol/(Lmin);
D.V(D)=1.6mol/(Lmin),
故选:B.
【考点精析】本题主要考查了反应速率的定量表示方法的相关知识点,需要掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t才能正确解答此题.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述不正确的是( ) 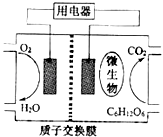
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O﹣24e﹣═6CO2+24H+
C.放电过程中,质子(H+)从负极区向正极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌粉、铝粉、镁粉的混合物a g与一定量的某浓度的稀硫酸恰好完全反应,蒸发水分后得固体(不含结晶水)b g,则反应中生成的氢气为( )
A.(b-a)/48 g
B.(b-a)/49 g
C.(b+a)/98 g
D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验操作中,不正确的是( )
A. 用灯帽盖灭酒精灯的火焰
B. 稀释浓硫酸时,将浓硫酸缓缓加到水中,并不断用玻璃棒搅拌
C. 将固体氢氧化钠直接放在托盘天平上称量
D. 给试管里的固体加热,试管口应稍稍向下倾斜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用30g乙酸和46g 乙醇反应,如果实际产量是理论产量的85%,则可得到的乙酸乙酯的质量是( )
A.37.4g
B.44g
C.74.8g
D.88g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍.又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后消耗后者的物质的量为 .
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 .
(3)单质B的燃烧热a kJ/mol.由B、C二种元素组成的化合物BC 14 g完全燃烧放出b kJ热量,写出单质B和单质C反应生成BC的热化学方程式: .
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2 . 在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1molA2C和1mol BC、2mol A2C和2mol BC.一定条件下,充分反应后分别达到平衡(两容器温度相等).下列说法正确的是
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ
D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定体积、一定物质的量浓度的溶液时,下列会使配得的溶液浓度偏大的是( )
A. 容量瓶中原有少量蒸馏水
B. 溶液从烧杯转移到容量瓶中后没有洗涤烧杯
C. 定容时观察液面俯视
D. 定容时倒转容量瓶几次,发现凹液面最低点低于标线,再补几滴水到标线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 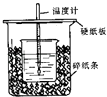
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol氢为2 g B. H2O的摩尔质量为18 g
C. 44 g CO2的体积为22.4 L D. 9.8 g H2SO4含0.1NA个H2SO4分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com